
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.分析 (1)依据热化学方程式和盖斯定律计算I+II-III得到CO2与NH3合成尿素和液态水的热化学反应方程式;
根据△G=△H-T△S判断温度;
(2)①已知4分钟时氮气为2.5mol,根据v(N2)=$\frac{△c}{△t}$计算;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B.催化剂改变反应速率不改变化学平衡;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
(3)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
②可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数 K=$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}].c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}].c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$×$\frac{c(A{g}^{+})}{c(A{g}^{+})}$=Ksp(AgCl)×K稳,根据化学平衡常数计算溶解AgCl的物质的量;
(4)工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2=CH-CN),根据反应物、生成物及反应条件书写方程式.
解答 解:(1)Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H=+116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H=+44.0kJ/mol
依据热化学方程式和盖斯定律计算I+II-III得到CO2与NH3合成尿素和液态水的热化学反应方程式为:
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0kJ/mol;
该反应△H<0、△S>0,所以△G=△H-T△S<0,在低温下即可自发进行,
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0kJ/mol;低温;
(2)①已知4分钟时氮气为2.5mol,则生成的N2为2.5mol,所以v(N2)=$\frac{△c}{△t}$=$\frac{\frac{2.5}{2}}{4}$mol•L-1•min-1=0.3125 mol•L-1•min-1,故答案为:0.3125mol•L-1•min-1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.使用催化剂A达平衡时,改变反应速率不改变化学平衡,N2最终产率不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,则化学平衡常数=$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}]}{c(A{g}^{+}).{c}^{2}(N{H}_{3})}$,
故答案为:$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}]}{c(A{g}^{+}).{c}^{2}(N{H}_{3})}$;
②可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数 K=$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}].c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}].c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$×$\frac{c(A{g}^{+})}{c(A{g}^{+})}$=Ksp(AgCl)×K稳=2.50×10-10×1.00×107=2.5×10-3,设溶解的AgCl物质的量为x,反应前后系数相同,可以用物质的量代替平衡浓度计算平衡常数,
AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq),
依据平衡常数=$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}].c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{{x}^{2}}{(1-2x)^{2}}$=2.5×10-3,
1-2x≈1,计算得到x=0.045mol,
故答案为:2.5×10-3;0.045;
(4)工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2=CH-CN),根据反应式、生成物及反应条件知,该反应的化学方程式为2CH2=CH-CH3+2NH3+3O2$\stackrel{一定条件下}{→}$ 2CH2=CH-CN+6H2O,
故答案为:2CH2=CH-CH3+2NH3+3O2$\stackrel{一定条件下}{→}$ 2CH2=CH-CN+6H2O.
点评 本题考查化学平衡计算、难溶物的溶解平衡计算、化学平衡影响因素、盖斯定律等知识点,侧重考查学生分析、计算及知识灵活运用能力,难点是难溶物的溶解平衡计算,注意(2)②D选项中容器绝热会导致反应过程中有温度变化,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的分子总数为0.2NA | |
| C. | 一定条件下,5.6 g铁与浓硫酸恰好反应,转移的电子数目一定为0.2NA | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$、$\frac{1}{22.4}$ | B. | $\frac{1}{3}$、$\frac{1}{33.6}$ | C. | $\frac{2}{3}$、$\frac{1}{11.2}$ | D. | $\frac{3}{4}$、$\frac{1}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
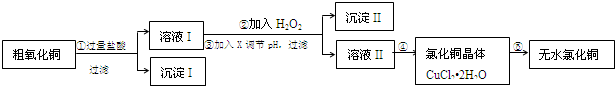
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已达平衡状态 | B. | V正>V逆 | ||
| C. | 未达平衡状态,平衡逆向移动 | D. | 无法确定是否达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com