
【题目】下列各个反应,不能用于工业生产的是( )
A.焦炭在高温下还原二氧化硅制粗硅
B.电解熔融氧化铝制金属铝
C.二氧化碳和氢氧化钠反应制碳酸钠
D.氯气与石灰乳反应制漂白粉
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】苯硫酚(C6H5-SH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(C6H5-Cl)和硫化氢(H2S)反应来制备苯硫酚,但会有副产物苯(C6H6) 生成。
I: C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
II: C6H5-Cl(g)+H2S(g)=C6H6(g)+HCl(g)+ ![]() S8(g) △H2
S8(g) △H2
反应II的焓变不易测量,现查表得如下数据:
Ⅲ: C6H5-SH(g)==C6H6(g)+ ![]() S8(g) △H3=-29.0 kJ/mol
S8(g) △H3=-29.0 kJ/mol
请回答:
(1)反应II为不可逆反应,请简述理由______________。
(2)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图1和图2。

①下列说法不正确的是____________。
A.由图1可知,相同条件下反应I的活化分子百分数大于反应II 的活化分子百分数
B.图1中C6H5-SH 的浓度在590℃随温度变化的原因可能是反应II 中消耗反应物,使反应I平衡逆向移动
C.其他条件不变,由图1可知,氯苯的转化率随温度的升高而降低
D.由图2 可知,若要提高C6H5-SH 的产量,可提高硫化氢与氯苯起始物质的量之比
②590℃时,氯苯和硫化氢混合气体(体积比1:2.5,总物质的量amol)在VL的固定容积中进行反应,达到平衡时,测得容器中苯硫酚的物质的量为a/7mol,苯的物质的量为a/l4mol,则该温度下反应I的平衡常数为____。(保留两位有效数字)
③请根据图1、图2,在右图中画出恒温恒容条件下反应主产物苯硫酚的物质的量浓度随时间变化的曲线图________

(3)除了用以上方法制备苯硫酚以外,亦可电解还原苯磺酸(C6H5-SO3H,一元强酸)或苯磺酰氯来制备。以锌和石墨为电极,硫酸为电解质溶液,电解苯磺酸时的阴极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
AlN 氮化铝是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素。回答下列问题:
(1)As基态原子的电子占据了______个能层,最高能级的电子排布式为______。和As位于同一周期,且未成对电子数也相同的元素还有______种。
(2)元素周期表中,与P紧邻的4种元素中电负性最大的是______ (填元案符号)。Si、P、S三种元素的 第一电离能由大到小的顺序是______。
(3)NH3、PH3、AsH3三者的沸点由高到低的顺序是______。原因是______。
(4)白磷是由P4分子形成的分子晶体,P4分子呈正四面体结构,P原子位于正四面体的四个顶点,则P原子的杂化形式为_____,白磷易溶于CS2,难溶于水,原因是__________________。
(5)采用GaxIn1-xAs(镓铟砷)等材料,可提高太阳能电池的效率。GaxIn1-xAs立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4 个原子,则该晶胞中含有_________个砷原子。
(6)AlN晶体的晶胞结构与金刚石相似(见下图),设晶胞的边长为ɑ pm,NA表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体。回答下列问题:
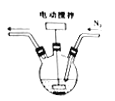
(1)碘化亚铁溶液的制备:将碘和铁粉按物质的量之比在![]() 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
①配料中铁粉过量的目的是____________;持续通入N2的目的是___________。
②检验反应液中不含碘单质的方法是___________。
(2)碘化钠溶液的制备:将制备好的碘化亚铁溶液加入碳酸氢钠溶液中,控制碘化亚铁与碳酸氢钠的物质的量之比在![]() ,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
(3)点化钠的提纯与结晶:
①除去碘化钠溶液中以HCO3-的方法是____________。
②从碘化钠溶液中获得碘化钠晶体(20℃时溶解度为179/100g水,100℃时溶解度为302/100g水)的操作方法是________________。
(4)碘化钠的提度的测定:
该小组同学称取制得的碘化钠晶体18.1g,溶于水后加入50mL2.5mol/LAgNO3溶液,过滤、洗涤、干燥,称得沉淀的质量为28.2g。则碘化钠晶体的纯度为_________。(杂质不参与反应,结果保留至小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程,属于放热反应的是( )
①水蒸气变成液态水 ②酸碱中和反应 ③浓硫酸稀释 ④碳与二氧化碳化合 ⑤H2在Cl2中燃烧 ⑥氯化钠电离
A.②③④⑤B.②③④C.②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A.元素周期表有7个周期,8个主族
B.元素周期表有18个纵行,共16个族
C.短周期元素中可能有副族元素
D.最外层电子数相同的元素一定在同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收.生活中废弃的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于( )
A.氧化物
B.盐
C.金属或合金
D.碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。下列说法中,不正确的是

A. K3AsO3溶液中的水解方程式:AsO33-+H2O![]() HAsO32-+OH-
HAsO32-+OH-
B. pH=12.8时,c(HAsO32-) >c(H2AsO3-)=c(AsO33-)
C. pH = 12时,溶液中c(H2AsO3-) + 2c(HAsO32-) + 3c(AsO33-) + c(OH-) = c(H+)
D. pH=9.2时,在H2AsO3-和H3AsO3的混合溶液中:c(H2AsO3-):c(H3AsO3)=1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com