
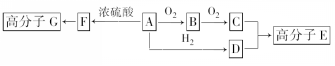
 .
. +2H2O.
+2H2O.分析 物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应,则A中含-CHO,A可发生连续氧化反应,则A中还含-CH2OH,则C应为二元酸,C的相对分子质量为104,去掉2个-COOH剩余原子总相对分子质量为104-45×2=14,则剩余基团为-CH2-,所以A为HOCH2CH2CHO,B为OHCCH2CHO,C为HOOCCH2COOH,A与氢气发生加成反应生成D为HOCH2CH2CH2OH,C与D发生缩聚反应生成高分子E,A发生消去反应生成F为CH2=CHCHO,F发生加聚反应生成高分子G.
解答 解:物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应,则A中含-CHO,A可发生连续氧化反应,则A中还含-CH2OH,则C应为二元酸,C的相对分子质量为104,去掉2个-COOH剩余原子总相对分子质量为104-45×2=14,则剩余基团为-CH2-,所以A为HOCH2CH2CHO,B为OHCCH2CHO,C为HOOCCH2COOH,A与氢气发生加成反应生成D为HOCH2CH2CH2OH,C与D发生缩聚反应生成高分子E,A发生消去反应生成F为CH2=CHCHO,F发生加聚反应生成高分子G.
(1)F为CH2=CHCHO,含有的官能团有醛基、碳碳双键,F发生加聚反应生成高分子G的结构简式为 ,
,
故答案为:醛基、碳碳双键; ;
;
(2)B发生银镜反应的化学方程式为:OHCCH2CHO+4Ag(NH3)2OH$\stackrel{△}{→}$4Ag+NH4OOCCH2COONH4+6NH3+2H2O,
故答案为:OHCCH2CHO+4Ag(NH3)2OH$\stackrel{△}{→}$4Ag+NH4OOCCH2COONH4+6NH3+2H2O;
(3)C、D在一定条件下反应还能生成环状化合物的化学反应方程式为:HOCH2CH2CH2OH+HOOCCH2COOH$→_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为:HOCH2CH2CH2OH+HOOCCH2COOH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;
(4)A(HOCH2CH2CHO)的同分异构体中所含官能团与A不同,但能与NaOH溶液反应,说明含有羧基与酯基,各种同分异构体的结构简式为:CH3CH2COOH、CH3COOCH3、HCOOCH2CH3,
故答案为:CH3CH2COOH、CH3COOCH3、HCOOCH2CH3.
点评 本题考查有机物的推断,充分利用A能发生银镜反应、消去反应、连续氧化反应为突破口,判断C含有的官能团,结合相对原子质量利用残余法确定C的结构,熟练掌握官能团的性质与转化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定只含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 仅含有共价键的化合物一定是共价化合物 | |
| D. | 由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
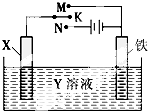 利用如图装置,能完成很多电化学实验.下列有关此装置的叙述中,错误的是
利用如图装置,能完成很多电化学实验.下列有关此装置的叙述中,错误的是| A. | 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 | |
| B. | 若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流的阴极保护法 | |
| C. | 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铁电极上的电极反应式为Cu2++2e-═Cu | |
| D. | 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,溶液中各离子浓度都不会变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子,锌是负极 | |
| B. | 电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 | |
| C. | 电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
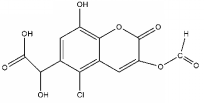
| A. | 能发生加成、取代、氧化反应 | |
| B. | 1 mol该物质最多可与7mol NaOH反应 | |
| C. | 1 mol该物质最多可与6 mol H2反应 | |
| D. | 能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
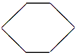 .
.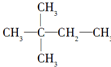 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com