
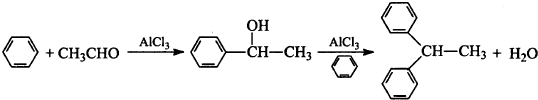
 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:分析 ①中和热的测定时,应用环形玻璃搅拌棒来搅拌;如果没有盖硬纸板,会导致热量的损失,据此分析对中和热的影响;
②根据在中和反应中,必须确保热量不散失来分析;
③氢氧化钠固体溶于水放出热量.
解答 解:①中和热的测定时,为了加快反应速率、使反应充分进行,应用环形玻璃搅拌棒来搅拌;如果没有盖硬纸板,会导致热量的损失,则导致所测得的中和热的数值偏小,故答案为:环形搅拌器(或环形玻璃棒);偏小;
②在中和反应中,必须确保热量不散失,故操作过程中的保温隔热是关键,故选B;
③氢氧化钠固体溶于水放热,所以实验中测得的“中和热”数值将偏大,故答案为:偏大;氢氧化钠固体溶于水放热.
点评 本题考查化学实验基本操作和中和热测定的实验,保温工作是实验成功的关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 K+,⑤的结构式是O=C=O.
K+,⑤的结构式是O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同分异构体 | |
| B. | 在一定的条件下,转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和分子晶体具有相同的物理性质和化学性质 | |
| D. | 在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 其分子式为C15H22O4 | |
| B. | 1 mol该物质与足量NaOH溶液反应,最多消耗2 mol | |
| C. | 一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 选择适宜的材料和试剂设计一个原电池,完成下列反应:
选择适宜的材料和试剂设计一个原电池,完成下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,片刻后有色布条褪色,说明有Cl2存在 | |
| B. | 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在 | |
| C. | 先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com