
【题目】下列有机物中,刚开始滴入NaOH溶液会出现分层现象,用水浴加热后分层现象消失的是( )
A.乙酸
B.乙酸乙酯
C.甲苯
D.汽油
【答案】B
【解析】
A.乙酸刚开始滴入NaOH溶液,乙酸和氢氧化钠反应生成乙酸钠和水,乙酸、乙酸钠易溶于水,所以刚开始滴入NaOH溶液不会出现分层现象,故A不符合题意;
B.乙酸乙酯不溶于水,也不与冷的NaOH溶液反应,用水浴加热在碱性条件下发生水解:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH,乙酸钠、乙醇易溶于水,分层现象逐渐消失,故B符合题意;
CH3COONa+C2H5OH,乙酸钠、乙醇易溶于水,分层现象逐渐消失,故B符合题意;
C.甲苯不溶于水,也不与氢氧化钠溶液反应,滴入热的氢氧化钠溶液中时分层现象不会消失,故C不符合题意;
D.汽油是多种烃的混合物,不溶于水,也不与氢氧化钠溶液反应,刚开始滴入NaOH溶液会出现分层现象,用水浴加热后分层现象不会消失,故D不符合题意;
故答案为B。


科目:高中化学 来源: 题型:
【题目】已知甲苯(![]() )能使酸性KMnO4溶液退色。某有机物的结构简式为
)能使酸性KMnO4溶液退色。某有机物的结构简式为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.该有机物使溴水褪色和在催化剂作用下与液溴反应原理一样
B.能用酸性KMnO4溶液判断分子中存在碳碳双键
C.该有机物在一定条件下与浓硝酸发生反应生成的一硝基取代物可能有3种
D.1 mol该有机物在一定条件下最多与4 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生命起源于原始海洋。科学家认为,由于海洋中铝离子的浓度极低,所以铝元素未成为人体的必需元素,它反倒对人体有害,铝主要损害脑细胞,是老年性痴呆的病因之一。1989年世界卫生组织把铝列为食品污染源之一,每日摄入量应控制在4 mg以下。若炸油条时1 kg面粉需加入0.5 kg水,4 g明矾和10 g小苏打及少量食盐等辅料,经烹炸,成品油条的产率一般为80%,通过计算说明若每天食用100 g油条,则摄入铝的量是
A.0.228 g
B.0.228 mg
C.18.8 mg
D.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是
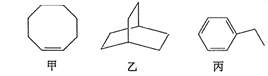
A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
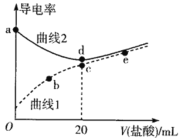
下列说法正确的是
A.曲线1代表四甲基氢氧化铵溶液
B.常温下,CH3NH3Cl水解常数的数量级为10-11
C.b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D.在b、c、e三点中,水的电离程度最大的点是e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某气态烷烃和烯烃(含一个双键)的混合气体2.24 L完全燃烧后,将产生的气体缓慢通过浓硫酸,浓硫酸增重4.05 g,剩余气体通过碱石灰,碱石灰增重6.60 g。另再取2.24 L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05 g。
(1)确定混合气体由哪两种烃组成_______。
(2)计算混合气体中两种烃的体积分数_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的实验,回答问题:
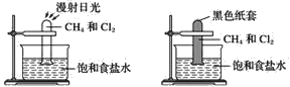
(1)装置A中的实验现象是____________________装置B中的实验现象是____
(2)根据上述实验,你能得出的结论是________________________________
(3)写出上述实验A中反应的化学方程式:
____________________________________________________;
____________________________________________________;
___________________________________________________;
______________________________________________________。
(4)上述反应的反应类型是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性.都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反应N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
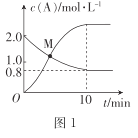
①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_______。
②M点时,N2H4的转化率为______(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡______(填“正向移动”“逆向移动”或“不移动”)。
(3)①在惰性气体中,将黄磷(P4)与石灰乳和碳酸钠溶液一同加入高速乳化反应器中制得NaH2PO2,同时还产生磷化氢(PH3)气体,该反应的化学方程式为________________。
②次磷酸(H3PO2)是一元酸,常温下.1.0 mol●L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=___________。
③用次磷酸钠通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于____(填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为______,当电路中流过3.8528×105库仑电量时.制得次磷酸的物质的量为_____ (一个电子的电量为 1.6×10- 19库仑,NA数值约为6. 02× 1023)。
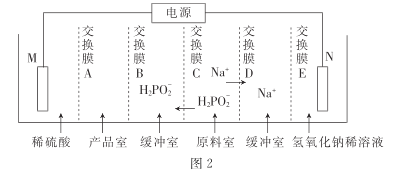
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
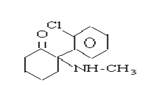
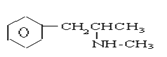
氯胺酮(K粉) 冰毒
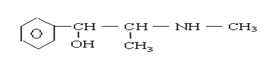
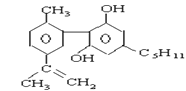
摇头丸 大麻
A.K粉的分子式为C13H16ClNO
B.这四种毒品都属于芳香烃
C.1mol大麻最多可与含4mol Br2的浓溴水发生反应
D.摇头丸不可能发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com