
 .
.分析 (1)钠和水反应生成氢氧化钠和氢气;
(2)钠投入到氯化铁溶液中:钠和水反应生成氢氧化钠和氢气,溶液呈碱性,氢氧化钠和氯化铁反应生成红褐色沉淀氢氧化铁;
(3)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
(4)Na2O2与CO2反应生成碳酸钠和氧气.
解答 解:(1)钠和水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=H2↑+2NaOH,故答案为:2Na+2H2O=H2↑+2NaOH;
(2)钠投入到FeCl3溶液中,发生反应为:2Na+2H2O═2NaOH+H2↑,3NaOH+FeCl3═Fe(OH)3↓+3NaCl,既有Na与H2O反应现象,又有NaOH与FeCl3反应现象.所以现象为:钠浮在液面上,与溶液剧烈反应,熔成小球,四处游动,发出嘶嘶声,有气泡冒出,有红褐色沉淀生成;故答案为:有大量气泡生成,有红褐色沉淀生成;(3)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
(4)Na2O2与CO2反应生成碳酸钠和氧气,该反应为2Na2O2+2CO2═2Na2CO3+O2,当有0.2mol电子发生转移时,生成0.1mol的氧气,所以氧气的体积为2.24L,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;2.24L.
点评 本题考查化学反应方程式的书写,明确物质的性质及发生的化学反应是解答的关键,难度不大,学生应熟练掌握化学用语的使用.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
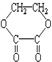 ⑤
⑤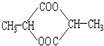 ⑥
⑥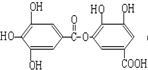 ⑦
⑦
| A. | ②⑤⑥⑦ | B. | ②④⑤⑦ | C. | ①②⑤⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 元素周期表中位于金属和非金属分界线附近能找到半导体的元素 | |
| C. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 | |
| D. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
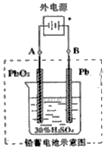 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水果、蔬菜含有丰富的维生素,若要减肥,每天只吃水果蔬菜即可 | |
| B. | 米饭含有大量的淀粉,成人每天食用量不能超过100g | |
| C. | 要促进身体健康,各种饮食必须合理搭配 | |
| D. | 鸡蛋含丰富的蛋白质,人体所需蛋白质都可由鸡蛋提供,多吃有益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏的各馏分均是纯净物 | |
| B. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| C. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| D. | 溴乙烷与NaOH水溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com