
溶液的酸碱性和pH:
(1)25 ℃,0.01 mol·L-1的盐酸中,c(OH-)=________ mol·L-1,pH=____________,由水电离出的c(H+)=________。
(2)100 ℃时,pH=6的水中c(H+)=________ mol·L-1,该水显________性。
(3)100 ℃时(Kw=10-12),0.01 mol·L-1的NaOH溶液的pH为________________,由水电离出的c(OH-)=________。
(4)25 ℃时,pH=8的CH3COONa溶液中c(OH-)=__________________,由水电离的c(OH-)=________________。
科目:高中化学 来源: 题型:
某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:
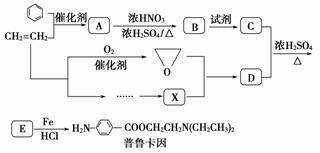
请回答下列问题:
(1)对于普鲁卡因,下列说法正确的是________。
A.可与浓盐酸形成盐
B.不与氢气发生加成反应
C.可发生水解反应
D.能形成内盐
(2)写出化合物B的结构简式________________。
(3)写出B→C反应所需的试剂________。
(4)写出C+D―→E的化学反应方程式__________________________________________
__________________________________________。
(5)写出同时符合下列条件的B的所有同分异构体的结构简式________。
①分子中含有羧基
②1HNMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子
(6)通常采用乙烯为原料制得环氧乙烷后与X反应合成D,请用化学反应方程式表示以乙烯为原料制备X的合成路线(无机试剂任选)。
__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则 ( )
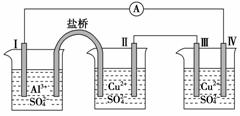
A. 电流方向:电极Ⅳ→Ⓐ→电极Ⅰ
B. 电极Ⅰ发生还原反应
C. 电极Ⅱ逐渐溶解
D. 电极Ⅲ的电极反应:Cu2++2e-===Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体X中可能含有NH3、Cl2、HBr、CO2中的一种或几种。已知将X通入硝酸银溶液中会产生淡黄色、不溶于稀硝酸的沉淀,若将X通入澄清石灰水中则没有沉淀产生。则下列有关气体X的说法正确的是( )
A.一定含有溴化氢、二氧化碳 B.可能含有二氧化碳
C.一定不含氨气、氯气 D.可能含有二氧化碳和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)可用于镀锡工业。某小组设计SnSO4制备路线为
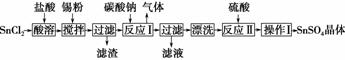
查阅资料:
Ⅰ.锡在酸性溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)锡原子的核电荷数为50,与碳元素同处 ⅣA族,锡位于周期表的第________周期。
(2)操作Ⅰ是 ________、过滤和洗涤等。
(3)溶解SnCl2粉末时需加浓盐酸,原因为__________________________________________________________。
(4)加入Sn粉的作用为①调节溶液pH,②__________________________________________________________。
(5)反应Ⅰ所得沉淀是SnO,其化学反应方程式:__________________________________________________________。
(6)酸性条件下,SnSO4与双氧水反应的离子方程式:__________________________________________________________。
(7)该小组通过下列方法可测定该锡粉的纯度:
①将试样溶于盐酸,反应为Sn+2HCl===SnCl2+H2↑
②加入过量的FeCl3
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,再计算锡粉的纯度,请配平反应:
FeCl2+____K2Cr2O7+____HCl===____FeCl3+____KCl+____CrCl3+____
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。请回答下列问题:
(1)混合后溶液的pH=8的原因是(用离子方程式表示):____________。
(2)混合溶液中由水电离出的c(H+)__________(填“<”、“>”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)。
(3)已知NH4A溶液为中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为________(填序号)。
a.NH4HCO3 b.NH4A
c.(NH4)2CO3 d.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3===Na++H++CO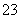
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO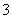 )+c(CO
)+c(CO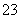 )
)
D.温度升高,c(HCO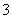 )增大
)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
HA为酸性略强于醋酸的一元弱酸,则下列叙述正确的是(双选)( )
A.0.1 mol·L-1 HA溶液中c(H+)=c(OH-)+c(A-)
B.0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液混合至溶液呈中性:c(Na+)=c(A-)
C.0.1 mol·L-1 NaA溶液中c(Na+)>c(OH-)>c(A-)>c(H+)
D.0.1 mol·L-1 HA溶液中加入少量NaA固体,HA的电离常数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com