
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
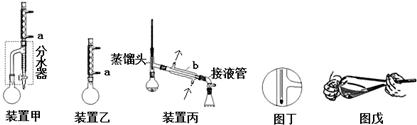
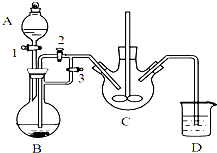
分析 (1)根据采用逆流的方法冷却效果好判断水流方向,根据装置图可知仪器名称;
(2)乙酸与正丁醇反应得到乙酸正丁酯与水,根据是否有水产生可判断反应是否基本完成;
(3)可用pH主试纸测有机层的酸碱性,用水洗有机物主要目的是除去有机物中少量的无机盐;
(4)分液漏斗的使用方法为:
A.分液漏斗使用前必须要检漏,要分液漏斗的旋塞芯处和上口的活塞都不漏水才可使用;
B.洗涤时振摇放气,应打开分液漏斗的旋塞,此时分液漏斗下管口应略高于口部;
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,使内外压强相等,便于液体流下;
D.洗涤完成后,先放出下层液体,然后从上口倒出有机层置于干燥的锥形瓶中;
(5)要蒸馏时,烧瓶最后留下的物质为沸点最高的物质,据此判断;若按图丁放置温度计,水银球的位置偏低,则收集到的产品馏分中还含有沸点较低的物质,据此判断;
(6)乙酸和正丁醇制备乙酸正丁酯是可逆反应,根据方案甲的实验装置图可知,该实验通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
解答 解:(1)由于采用逆流的方法冷却效果好,所以a处水流方向是进水,根据装置图可知仪器b的名称是(直形)冷凝管,
故答案为:进水;(直形)冷凝管;
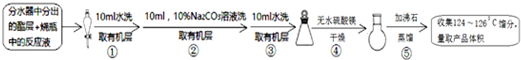
(2)乙酸与正丁醇反应得到乙酸正丁酯与水,所以方案甲监控酯化反应已基本完成的标志是分水器中水不再生成或分水器中的水层不再增加时,
故答案为:分水器中水不再生成或分水器中的水层不再增加时;
(3)可用pH主试纸测有机层的酸碱性,其操作为用玻璃棒蘸取有机层,点在pH试纸上,与标准比色卡对照,读取pH值判断,用水洗有机物主要目的是除去溶于酯中的少量无机盐,
故答案为:用玻璃棒蘸取有机层,点在pH试纸上,与标准比色卡对照,读取pH值判断;除去溶于酯中的少量无机盐;
(4)分液漏斗的使用方法为:
A.分液漏斗使用前必须要检漏,要分液漏斗的旋塞芯处和上口的活塞都不漏水才可使用,故A错误;
B.洗涤时振摇放气,应打开分液漏斗的旋塞,此时分液漏斗下管口应略高于口部,故B正确;
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,使内外压强相等,便于液体流下,故C正确;
D.洗涤完成后,先放出下层液体,然后从上口倒出有机层置于干燥的锥形瓶中,故D错误,
故答案为:BC;
(5)要蒸馏时,烧瓶最后留下的物质为沸点最高的物质,所以最后圆底烧瓶中残留的液体主要是正丁醚;若按图丁放置温度计,水银球的位置偏低,则收集到的产品馏分中还含有沸点较低的物质,所以收集到的产品馏分中还含有正丁醇,
故答案为:正丁醚;正丁醇;
(6)乙酸和正丁醇制备乙酸正丁酯是可逆反应,根据方案甲的实验装置图可知,该实验通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率,
故答案为:方案甲;通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
点评 本题考查有机物的合成实验,涉及化学仪器及使用、反应原理、实验基本操作、装置图的分析等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原产物为NH4+ | |
| B. | 若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ | |
| C. | Fe3+和Fe2+分别属于反应物和生成物 | |
| D. | 氧化剂与还原剂的物质的量之比为1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com