
����Ŀ������֬�ް�סԼ0.2gNa2O2��ĩ������ʯ�����ϣ�����֬���ϵ�ˮ����ͼ1�����ɹ۲쵽��֬����ȼ��������

��1����ʵ���������ó����й�Na2O2��H2O��Ӧ�Ľ������£��벹��������
a.��___���ɣ�b.��Ӧ���ȣ�
Na2O2��ˮ��Ӧ�Ļ�ѧ����ʽ��__��
��2��ij�о���ѧϰС������ͼ2װ�ý���ʵ�飬��֤���������ۡ�

��������֤����a��ʵ�鷽������Һ©��������__��
��������֤����b��ʵ�鷽������Ӧǰ��q���ܿ�����һ�ܽ���ʢ��ˮ��ˮ���У�����ˮ�۲쵽___��֤����Ӧ�Ƿ��ȵġ�
��3��ʵ�飨2�����Թ��м�ˮ��������ȫ�ܽ��Ҳ������������ɺ�ȡ���Թܣ����Թ��е����̪��Һ��������Һ��죬��ɫ��ȥ�������ɫ���������Ϸ���ԭ��֮һ�Ƿ�Ӧ����Һ����H2O2��ʹ��̪����Ư�ס�ͬѧ����Ӧ����Һ�м���FeSO4��Һ���ɹ۲쵽__ɫ�������ɣ��÷�Ӧ�����ӷ���ʽ��__��
���𰸡�O2 2Na2O2+2H2O=4NaOH+O2�� �ô����ǵ�ľ������p���ܿڣ����۲쵽ľ����ȼ��֤����O2���� ������ð�� ��� 2Fe2++H2O2+4OH-=2Fe(OH)3��
��������
��1����֬����ȼ�գ�˵���߱�ȼ������������ȼ�յ��������÷�ӦΪ���ȷ�Ӧ�������������ɣ���ѧ��Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2�����ʴ�Ϊ��O2��2Na2O2+2H2O=4NaOH+O2����
��2������������ʹ�����ǵ�ľ����ȼ�����ʣ����Կ��ô����ǵ�ľ������p�������ľ����ȼ�������������ɣ���֮���������ɣ��ʴ�Ϊ���ô����ǵ�ľ������p���ܿڣ����۲쵽ľ����ȼ��֤����O2���ɣ�
����������������������ʣ�����÷�Ӧ���ȣ��ų���������ʹ����ƿ�ڿ�����ѹǿ�������q���ܲ���ʢˮ��С�ձ��У�������ð����֤���˷�Ӧ���ȣ��ʴ�Ϊ��������ð����
��3����Ӧ����Һ�У������̪��Һ��������Һ��죬˵����Һ�Լ��ԣ���ɫ��ȥ����H2O2��H2O2����ǿ�����ԣ��ڼ��������£�FeSO4��H2O2�����������������ĺ��ɫ�����������ӷ�Ӧ����ʽΪ��2Fe2++H2O2+4OH-=2Fe(OH)3�����ʴ�Ϊ����֣�
2Fe2++H2O2+4OH-=2Fe(OH)3����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ����ʻ�Ӧ�õ�˵����ȷ���ǣ� ��
A.�ڼױ��м����������Ը��������Һ������ɫ����ȷ�Ľ��������ڲ����뱽�����Ӱ�죬ʹ�����ͱ������ױ�����
B.�ú˴Ź�������1-����2-����
C.����屽����һ�ֿռ�ṹ��֤���������в����ڵ�˫������Ľṹ
D.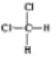 ��
��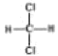 ��
�� ��
��![]() ����ͬ���칹��
����ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A.��1 mol NH4Cl��������ϡ��ˮ��Ϻ���Һ�����ԣ�����Һ��NH4+��ĿΪNA
B.��Ũ����ֱ���MnO2��KClO����Ӧ�Ʊ�1 mol������ת�Ƶĵ�������Ϊ2NA
C.��ҵ�ϵ�⾫����ʱ����������������10.8 g�����·��ת�Ƶ�������Ϊ0.1NA
D.1.0 g��H218O��D216O��ɵĻ����������������Ϊ0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��������пո�
��Ϊ����SO2���ŷţ�����ȡ���´�ʩ����úת��Ϊ��������ȼ�ϡ���֪��
��H2(g)��![]() O2(g)=H2O(g) ��H1����241.8kJ��mol��1
O2(g)=H2O(g) ��H1����241.8kJ��mol��1
��C(s)��![]() O2(g)=CO(g) ��H2����110.5kJ��mol��1
O2(g)=CO(g) ��H2����110.5kJ��mol��1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ____________��
�������ʵ�����A��B�����2L���ܱ������У��������·�Ӧ��3A(g) +B(g) ![]() xC(g) +2D(g)����5min���D��Ũ��Ϊ0.5molL��1��C��ƽ����Ӧ������0.1mol/(Lmin)���Ҵ�ʱA�����ʵ���Ũ��Ϊ0.25molL��1��
xC(g) +2D(g)����5min���D��Ũ��Ϊ0.5molL��1��C��ƽ����Ӧ������0.1mol/(Lmin)���Ҵ�ʱA�����ʵ���Ũ��Ϊ0.25molL��1��
��1��x��ֵ��_____��
��2��B��ƽ����Ӧ����_____��
��3����Ӧ��ʼǰ����������A�����ʵ���_____��
��1��CO2��NaCl��Na��Si��CS2���������ʵ��۵��ɸߵ��͵�˳����________���÷���ʽ��ѧʽ��ʾ����
��2��A��B��C��DΪ���־��壬�������£�
A��̬ʱ�ܵ��磬������������B������CS2��������ˮ��
C��̬ʱ�����磬Һ̬ʱ�ܵ��磬������ˮ��D��̬��Һ̬ʱ�������磬�۵�Ϊ3500 �棻
���ƶ����ǵľ������ͣ�A_____��B_____��C_____��D_____��
��3����������Ӧ��������ɱ�Ϊ1��3�Ļ�����û���������幹��Ϊ_____������ԭ�ӵ��ӻ��������Ϊ_____������ԭ�ӵļ۲���Ӷ���Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������������������������к�Al2O3��Fe2O3��FeO��SiO2�ȣ�Ϊԭ���Ʊ����߷����������ۺϼ�ʽ�Ȼ��������������£�
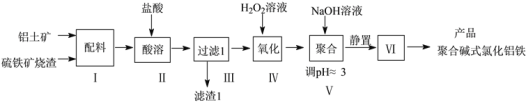
��1�����������ʱ��Fe2O3���ܽ�Ļ�ѧ��ʽΪ____������1�ijɷ�Ϊ____���ѧʽ����
��2�������������Ӧ�����ӷ���ʽΪ________________��
��3������V������ҺpH����6��������ɵ�Ӱ����_______������������IJ�����_______��
��4���ⶨ�ۺϼ�ʽ�Ȼ�����{�ɱ�ʾΪ[FeaAlb(OH)xCly]n}��n(Al)/n(Fe)�ı�ֵ�IJ������£�
����1.ȷ��ȡ��Ʒ5.710g����ˮ������������ϡ��ˮ�����ˣ��������������������ٱ仯���õ�3.350 g���塣
����2.��ȷ��ȡ2.855g��Ʒ����������NaOH��Һ�����ˣ����ϴ�ӣ��������������������ٱ仯���õ�����0.4000g��
�����Ʒ��n(Al)/n(Fe)�ı�ֵ��д��������̣���__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ������������������ֶ�����Ԫ�أ����н�����һ�ֽ���Ԫ�أ�A��D������������ͬ;B��C��E�����ڱ������ڣ���C��Eͬ���塣B��C������������֮�͵���D��ԭ�Ӻ����������A��C���γ����ֳ�����Һ̬�����
��ش��������⣺
��1��C��D��E����ԭ�Ӷ�Ӧ�����Ӱ뾶�ɴ�С��˳����___________(��������ӷ���);��A��B��C����Ԫ�ذ� 4:2:3��ɵĻ����������Ļ�ѧ����������_____________________��
��2����ij�ַ����Ľ����������� A��C��D��ɵĻ�������Һ��Ӧ���÷�Ӧ�����ӷ���ʽΪ��______________________________________________________��
��3��A��C��Ԫ�صĵ���������K2CO3����ɵ�ȼ�ϵ�أ��为����ӦʽΪ_______________________��
�øõ�ص��1L1mol/LNaCl��Һ�������ı�״����1.12LA2ʱ�� NaCl��Һ��pH��_____(�������������Һ���������) ��
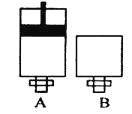
��4�����淴Ӧ2EC2������+C2������![]() 2EC3�������������ܱ������н���, A��������һ���������ƶ��Ļ����� B �����ɱ��ֺ��� ����ͼ��ʾ�� ,���� A ��B �зֱ����lmolC2��2molEC2��ʹV (A ) =V( B ) ������ͬ�¶��·�Ӧ����ƽ������ʱ�䣺t(A )______t ( B )�����������������ȷ������ͬ����ƽ��ʱ EC2��ת���ʣ�a�� A )_______ a�� B ����
2EC3�������������ܱ������н���, A��������һ���������ƶ��Ļ����� B �����ɱ��ֺ��� ����ͼ��ʾ�� ,���� A ��B �зֱ����lmolC2��2molEC2��ʹV (A ) =V( B ) ������ͬ�¶��·�Ӧ����ƽ������ʱ�䣺t(A )______t ( B )�����������������ȷ������ͬ����ƽ��ʱ EC2��ת���ʣ�a�� A )_______ a�� B ����
��5�����Ƚ�C��E��Ԫ�صķǽ��������ǿ�����ɲ�ȡ�Ĵ�ʩ��_____________(���������)��
a.�Ƚ�������Ԫ�ص���̬�⻯��ķе�
b.�Ƚ�������Ԫ�صĵ����ڳ����µ�״̬
c.�Ƚ�������Ԫ�ص���̬�⻯����ȶ���
d.�Ƚ�������Ԫ�صĵ������������ϵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯�����г����ķ�ӦΪ![]()
![]() ijʵ��С����ʵ����ģ��������Ӧ��һ���¶��£���
ijʵ��С����ʵ����ģ��������Ӧ��һ���¶��£���![]() ʢ��
ʢ��![]() ��ĩ�ĺ����ܱ�������ͨ��
��ĩ�ĺ����ܱ�������ͨ��![]() ��5minʱ����
��5minʱ����![]() ����CO��ʾ��ƽ����Ӧ������______
����CO��ʾ��ƽ����Ӧ������______![]() ��5minʱCO��ת����Ϊ______��������ʱ��Ӧ��ϵ�еĻ������ͨ��
��5minʱCO��ת����Ϊ______��������ʱ��Ӧ��ϵ�еĻ������ͨ��![]() ��NaOH��Һ�У�������Һ������Ũ���ɴ�С��˳����______��
��NaOH��Һ�У�������Һ������Ũ���ɴ�С��˳����______��
![]() ������Ӧ��ƽ�ⳣ������ʽ
������Ӧ��ƽ�ⳣ������ʽ![]() ______���жϸ÷�Ӧ�Ѿ��ﵽƽ��״̬��������______
______���жϸ÷�Ӧ�Ѿ��ﵽƽ��״̬��������______![]() �����
�����![]() ��
��
![]() �����ڹ����������ֲ���
�����ڹ����������ֲ��� ![]() ����������ѹǿ���ֲ���
����������ѹǿ���ֲ���
![]()
![]()
![]() ��֪������Ӧ��ƽ�ⳣ��K���¶�
��֪������Ӧ��ƽ�ⳣ��K���¶�![]() ��λ��
��λ��![]() ֮��Ĺ�ϵ��ͼ��ʾ��
֮��Ĺ�ϵ��ͼ��ʾ��

����ͼ���֪���÷�Ӧ��ƽ�ⳣ���¶����߶�______![]() ��������������С����������
������������������������![]() ��
��
![]() ��������й���Ϣ��ָ���������CO��ƽ��ת���ʵĴ�ʩ��______
��������й���Ϣ��ָ���������CO��ƽ��ת���ʵĴ�ʩ��______![]() д����
���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����úֱ����Ϊȼ��ȼ�գ�������Ч�ʽϵͣ��Ҳ����̳���������������������ʣ�������صĻ�����Ⱦ��ú�ĸ��������ú�������ʡ�������Ҫ����ԭ�ϡ�������Ⱦ���ŷ�������Ч��ʩ֮һ��ij��ѧѧϰС����ʵ����������̽��ú����������װ����ͼ��ʾ����ش��й����⣺
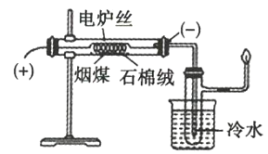
��1��ú�����������___��
��2��ʢ����ˮ���ձ���������___��
��3��ʵ�������дְ�ˮ���ɵIJ�����___��
��4����֪CO����ʹ��ˮ��ɫ�������Ӿ�֧�Թ�֧�ܿڴ��ݳ�������ͨ����ˮ�У�������ˮ��ɫ����˵��ú�ĸ��������___��
��5����ú�����з���������ױ������ױ���ʵ�鷽����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ![]() ��ƽ���ֳ����ݡ�������һ��������ͭ�ۣ�������ܽ�
��ƽ���ֳ����ݡ�������һ��������ͭ�ۣ�������ܽ�![]() ������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ
������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ![]() ��֪����ֻ����ԭΪNO����
��֪����ֻ����ԭΪNO����![]() �����з��������������
������������������![]()
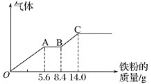
A.ԭ�������![]() ���ʵ���Ϊ
���ʵ���Ϊ![]()
B.OA�β�������NO��AB�εķ�ӦΪ![]() ��BC�β�������
��BC�������
C.�ڶ�����Һ����������Ϊ![]()
D.![]() Ũ��Ϊ
Ũ��Ϊ![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com