
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)
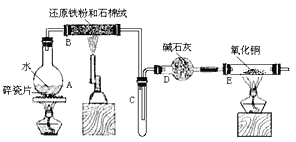
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作是 ________________。 装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C中玻璃管处点燃该气体,则必须对该气体行________________,装置E中的现象是 _______________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 _____________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
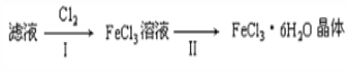
① 步骤I中通入Cl2的作用是__________________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:______________________
【答案】防止暴沸 3Fe+4H2O(g) ![]() Fe3O4+4H2。 检验纯度 固体由黑色变为红色,管壁有水珠 取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色 将滤液中含有的Fe2+氧化成Fe3+ 加热浓缩、冷却结晶、过滤
Fe3O4+4H2。 检验纯度 固体由黑色变为红色,管壁有水珠 取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色 将滤液中含有的Fe2+氧化成Fe3+ 加热浓缩、冷却结晶、过滤
【解析】
(1)加热液体时可能发生剧烈沸腾,碎瓷片可防止暴沸;B中Fe与水蒸气反应生成四氧化三铁和氢气;
(2)生成氢气具有可燃性,若氢气不纯,点燃时可能发生爆炸,E中氢气还原CuO生成Cu、水;
(3)KSCN溶液遇铁离子为血红色;
(4)滤液中可能含亚铁离子,通入氯气,氯气与亚铁离子反应生成氯化铁。
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是防止暴沸;装置B中发生反应的化学方程式是3Fe+4H2O(g) ![]() Fe3O4+4H2,故答案为:防止暴沸,3Fe+4H2O(g)
Fe3O4+4H2,故答案为:防止暴沸,3Fe+4H2O(g) ![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)如果要在C中玻璃管处点燃氢气,则必须对该气体进行检验纯度,E中氢气还原CuO,观察到的现象为固体由黑色变为红色,管壁有水珠,
故答案为:检验纯度;固体由黑色变为红色,管壁有水珠。
(3)检验滤液中Fe3+的操作方法为取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色,
故答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色。
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,2Fe2++Cl2═2Fe3++2Cl-,
故答案为:将滤液中含有的Fe2+氧化成Fe3+。
②由FeCl3稀溶液得到FeCl36H2O晶体,需加热浓缩、冷却结晶、过滤,
故答案为:加热浓缩、冷却结晶、过滤。


科目:高中化学 来源: 题型:
【题目】某工厂的一个生产工艺流程如图所示,下列叙述正确的是( )
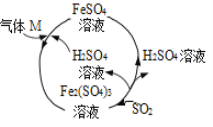
A. 该工艺流程的目的是制备 Fe2(SO4)3
B. 气体 M一定是 SO3
C. 气体 M 参加的反应是化合反应
D. SO2 参加反应时氧化剂和还原剂的物质的量之比是 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物的性质,设计如下实验。请回答下列问题:

(1)装置b的名称______________;按如图所示装置进行实验(夹持装置及尾气处理装置未画出)。实验过程中,装置B中观察到的现象是________________;装置C中有白色沉淀生成,该沉淀是____(填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_______________________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置(最简单)连接A装置中c处管口,从左到右的顺序为_____________________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是_____________________________。



碱石灰① 品红溶液② 高锰酸钾溶液③ 澄清石灰水④
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是____________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验最终能看到白色沉淀的是( )
A.二氧化碳或二氧化硫通入氯化钙溶液中
B.过量二氧化碳通入澄清石灰水中
C.过量二氧化硫通入氢氧化钡溶液中
D.过量二氧化碳通入硅酸钠溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间可能包括多步反应,其总的离子方程式正确的是 ( )
A. 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O===HClO+HSO3-
B. 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 向 AlCl3溶液中投入过量Na:Al3++4Na+2H2O===AlO2-+4Na++2H2↑
D. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)等,一种综合利用工艺设计如下:
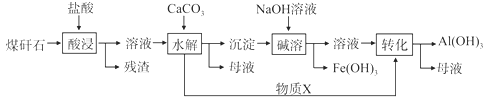
(1)物质X的化学式为__________________
(2)“酸浸”过程中主要反应的离子方程式为:________________,________________
(3)“碱溶”的目的是___________________
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
A. 它是副族元素 B. 它是第六周期元素
C. 它的原子核内有63个质子 D. 它的一种同位素的核内有89个中子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com