
【题目】脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)次氯酸盐氧化法。次氯酸盐脱除NO的主要过程如下:
i. NO+HClO=NO2+HCl
ii. NO+NO2+H2O![]() 2HNO2
2HNO2
iii. HClO+HNO2=HNO3+HCl
①下列分析正确的是______(填字母)。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
②研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图1所示

脱除过程中往往有Cl2产生,原因是______(用离子方程式表示);60~80℃NO脱除率下降的原因是______。
(2)尿素[CO(NH2)2]还原法。NO和NO2以物质的量之比1﹕1与CO(NH2)2反应生成无毒气体的化学方程式为______。
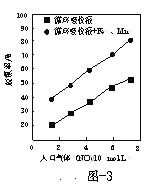
(3)脱氮菌净化法。利用脱氮菌可净化低浓度NO烟气,当烟气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如题16图2、题16图3所示。
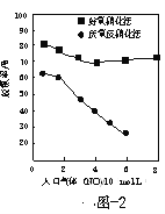
①由题图2知,当废气中的NO含量增加时,提高脱氮效率宜选用的方法是______。
②题图3中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为______。
【答案】AC ClO-+Cl-+2H+=Cl2↑+H2O(或HClO+Cl-+H+=Cl2↑+H2O) HClO受热分解,溶液中c(HClO)减小或气体溶解度随温度升高而降低 CO(NH2)2+NO+NO2=2N2+CO2+2H2O 好氧硝化法 Fe2+、Mn2+对该反应有催化作用
【解析】
(1)在脱除![]() 的过程中,次氯酸作氧化剂,
的过程中,次氯酸作氧化剂,![]() 作还原剂,二者经一系列氧化还原后得到硝酸和盐酸,起到了
作还原剂,二者经一系列氧化还原后得到硝酸和盐酸,起到了![]() 的脱除作用;
的脱除作用;
(2)尿素中的氮是-3价的,相当于与![]() 中+2价的氮和
中+2价的氮和![]() 中+4价的氮发生归中反应,得到氮气这种无毒气体;
中+4价的氮发生归中反应,得到氮气这种无毒气体;
(3)根据题图不难看出最佳的脱氮方法是好氧硝化法(方框),而过渡金属阳离子往往具有很好的催化能力。
(1)①A.若烟气中含有少量的氧气,氧气可以将![]() 氧化为
氧化为![]() ,促进最终转变为硝酸,因此能提高
,促进最终转变为硝酸,因此能提高![]() 的脱除率,A项正确;
的脱除率,A项正确;
B.![]() 可以与水反应得到硝酸和
可以与水反应得到硝酸和![]() ,而生成的
,而生成的![]() 又可以和
又可以和![]() 反应得到亚硝酸,因此也可以脱除,B项错误;
反应得到亚硝酸,因此也可以脱除,B项错误;
C.次氯酸盐是弱酸强碱盐,呈碱性,而反应产物硝酸是强酸,故pH在下降,C项正确;
②既然产生了氯气,则证明![]() 被还原,溶液中一定存在一种还原性的物质,只能是
被还原,溶液中一定存在一种还原性的物质,只能是![]() ,也就是二者的归中反应:
,也就是二者的归中反应:![]() ,当温度升高,次氯酸受热分解,就会导致脱除率下降;
,当温度升高,次氯酸受热分解,就会导致脱除率下降;
(2)根据分析,写出归中反应方程式:![]() ;
;
(3)①图中不难看出好氧硝化法的脱氮率更高;
②![]() 和
和![]() 并不直接参与反应,因此推测起到了催化作用。
并不直接参与反应,因此推测起到了催化作用。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
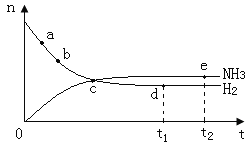
A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻,n(H2)比右图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知Ni(CO)4(s)=Ni(s)+4CO(g)ΔH=Q kJmol﹣1,则:Ni(s) + 4CO(g)=Ni(CO)4(s)ΔH=﹣Q kJmol﹣1
B.在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=﹣19.3kJ/mol
2NH3(g) ΔH=﹣19.3kJ/mol
C.已知2H2(g)+O2(g)=2H2O(l)ΔH1,2H2(g)+O2(g)=2H2O(g)ΔH2,则ΔH1>ΔH2
D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2和CO以![]() =2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)
=2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
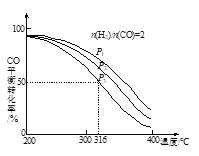
A.该反应的△H<0
B.压强大小:P1<P2<P3
C.在316℃时,该反应的平衡常数为0.25
D.若在P3和316℃时,起始时![]() =3,则达到平衡时,CO转化率大于50%
=3,则达到平衡时,CO转化率大于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型双膜锌碘单流电池的工作原理如图所示,放电过程中两膜之间的KCl溶液浓度不断降低。下列说法正确的是

A.锌电极电势高于多孔碳电极电势
B.cd膜可以选用阴离子交换膜
C.多孔碳电极上发生的电极方程式为I3-+2e-=3I-
D.若导线上通过1 mol电子,会有1 mol K+通过ab膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验分析错误的是![]()
A.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学来源于生活又服务于生活,请用化学用语回答下列问题:
(1)漂粉精中有效成分的化学式为:___________
(2)“硅材料”是无机非金属材料的主角,其中广泛应用于光导纤维的材料是:____________
(3)向浑浊的水中加入明矾KAl(SO4)2·12H2O后,水可得到净化。写出明矾在水中的电离方程式:___________。往明矾溶液中逐滴加入Ba(OH)2溶液,若使SO42- 恰好完全沉淀,发生反应的离子方程式为:___________;若使Al3+恰好完全沉淀,发生反应的离子方程式为:_____。
(4)饮用水中的NO3-对人类健康产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为: 10Al + 6NaNO3 + 4NaOH = 10NaAlO2 + 3N2↑ + 2H2O
请回答下列问题:
①在化学方程式上用单线桥标出该反应中电子转移的方向和数目:____________
②上述反应中若生成标准状况下3.36LN2,则转移的电子数目为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益.其分子结构如图所示,下列说法不正确的是( )
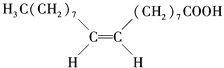
A. 油酸的分子式为C18H34O2
B. 油酸可与氢氧化钠溶液发生中和反应
C. 1mol油酸可与2molH2发生加成反应
D. 1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com