
0.1mol/L NH4Cl溶液中,下列叙述错误的是 ( )
A.c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.c(Cl—)>c(NH4+)>c(H+)>c(OH—)
C.c(NH4+)+c(H+)=c(Cl—)+c(OH—)
D.c(NH4+)+c(NH3 ·H2O)=c(Cl—)
·H2O)=c(Cl—)
科目:高中化学 来源: 题型:选择题
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4是N2的同素异形体 | |
| C. | N4分子中N-N键角为109°28′ | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式碳酸铜、烧碱均属碱 | |
| B. | CO、SO2均属酸性氧化物 | |
| C. | 凡能电离出H+的化合物均属酸 | |
| D. | 盐类物质一定含有金属离子或铵根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出248 kJ的热量 | B. | 吸收248 kJ的热量 | ||
| C. | 放出183 kJ的热量 | D. | 吸收183 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
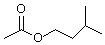 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
下列溶液肯定呈酸性的是( )
A.含有H+离子的溶液 B.酚酞显无色的溶液
C.C(OH-)<C(H+)的溶液 D.pH小于7的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com