
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等),某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量盐酸后过滤出的滤渣中含有____________________,加入过量的NaOH溶液,过滤后的滤液中含有的溶质有_______________________(均填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,则每消耗0.1mol氧气有多少_____mol Fe(OH)2被氧化。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为___________________,沉淀A加热得到Al2O3的化学方程式为____________________。
(4)假设铝土矿中含杂质49%,则1吨铝土矿理论上可生产多少__________mol铝。
【答案】SiO2 NaOH NaAlO2 NaCl 0.4 AlO2-+CO2+2H2O===Al(OH)3↓+HCO3- 2Al(OH)3![]() Al2O3+3H2O 10000
Al2O3+3H2O 10000
【解析】
铝土矿的成分是Al2O3、Fe2O3、FeO、SiO2,其中Al2O3为两性氧化物,Fe2O3、FeO为碱性氧化物,SiO2为酸性氧化物,加入盐酸,发生Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,过滤,滤液中含有Al3+、Fe3+、Fe2+、H+、Cl-,加入过量的NaOH溶液,发生H++OH-=H2O、Al3++4OH-=AlO2-+2H2O、Fe3++3OH-=Fe(OH)3↓、Fe2++2OH-=Fe(OH)2↓,过滤,滤液2中含有离子是Na+、OH-、AlO2-、Cl-,通入过量CO2,发生OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,沉淀A为Al(OH)3,沉淀A受热分解为氧化铝和水,然后逐步分析;
(1)根据上述分析,加入过量的盐酸后,滤出的滤渣为SiO2,加入过量的NaOH溶液,过滤后的滤液中含有的溶质为NaCl、NaAlO2、NaOH;
(2)氢氧化亚铁被氧气氧化成氢氧化铁,根据得失电子数目守恒,0.1mol×2×2=n[Fe(OH)3]×1,即n[Fe(OH)3]=0.4mol;
(3)通入过量CO2,发生OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,因此生成氢氧化铝沉淀的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;氢氧化铝受热分解:2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(4)铝土矿中含杂质为49%,则含氧化铝为51%,根据铝元素守恒,因此有![]() =n(Al),解得n(Al)=10000mol。
=n(Al),解得n(Al)=10000mol。


科目:高中化学 来源: 题型:
【题目】(1)科学家最近研制出利用太阳能产生激光,使海水分解。
①太阳光分解海水时,光能转化为_____能,水分解时,断裂的化学键是_____(填“离子键”或“共价键”)
②已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则2H2(g)+O2(g)=2H2O(l) H=_____kJ·mol-1
(2)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为2Fe+O2+2H2O=2Fe(OH)2,
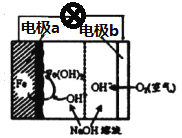
①Fe为原电池的______(填“正极”或“负极”),电极b上发生_____反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1的FeCl2溶液中:H+、Al3+、SO42—、ClO
B. 无色透明的溶液中:Al3+、Fe3+、NO3—、SCN—
C. 与Al反应能放H2的溶液中:Cu2+、NH4+、CO32-、Cl
D. c(OH)/c(H+)=1×1014的溶液中:K+、Na+、I、SiO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. a点溶液中: c(OH-)+c(CH3COO-)-c(H+) =0.1 mol/L
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH。起始时只充入CH4与H2O(g),设
CO(g)+3H2(g) ΔH。起始时只充入CH4与H2O(g),设![]() =Z,保持反应压强不变,平衡时CH4的体积分数ω(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
=Z,保持反应压强不变,平衡时CH4的体积分数ω(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
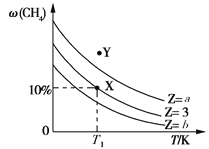
A. a>3>b
B. 保持温度不变,平衡体系加压后ω(CH4)增大
C. 温度为T1、Z=3时,Y点所对应的反应向逆反应方向进行
D. X点时,H2的体积分数为30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验处理,结果得到酸性溶液,还有少量气体剩余,则气体甲的组成可能为
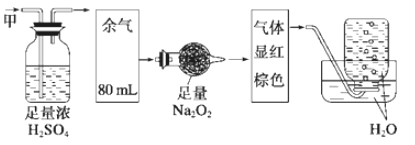
A. NH3、NO、N2B. NH3、NO、CO2
C. NH3、NO2、CO2D. NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需用坩埚钳夹取加热后的蒸发皿
B. 容量瓶使用前无需检漏
C. 蒸馏实验结束后,先停止通冷凝水,再停止加热
D. 焰色实验所用的铂丝,每次用完后都要用稀硫酸洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为____________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
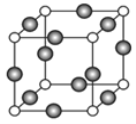
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com