
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是

A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
【答案】D
【解析】
由图中得失电子可知,电极1为负极,电极2为正极,负极发生:BH4-+8OH-一8e-═B(OH)4-+4H2O,正极发生还原反应,废水中Cu2+及H+在正极上得到电子被还原,1室中Na+、K+透过X膜向2室迁移,SO42-透过Y膜向2室迁移,故X、Y依次为阳离子、阴离子选择性交换膜,在2室流出的溶液为Na2SO4和K2SO4溶液。
A、由图中得失电子可知,电极1为负极,电极2为正极,1室中Na+、K+透过X膜向2室迁移,SO42-透过Y膜向2室迁移,故X、Y依次为阳离子、阴离子选择性交换膜,在2室流出的溶液为Na2SO4和K2SO4溶液,故A正确;
B、在原电池中负极发生氧化反应,故B项正确;
C、由A分析可知:在2室流出的溶液为Na2SO4和K2SO4溶液,故C正确;
D、正极发生还原反应,废水中Cu2+及H+在正极上得到电子被还原,故D错误。
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)![]() 2C(g),可以判断达到化学平衡状态的是( )
2C(g),可以判断达到化学平衡状态的是( )
A. 体系压强不变 B. 单位时间消耗n molA,同时生成2nmolC
C. A的转化率不变 D. 容器内气体密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。

(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)
(2)试写出B溶液中的溶质的化学式:_____________
(3)写出化学方程式:
①铝土矿→A:_________________________________________________。
②E→F:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法中正确的是( )
A.2min末时,A和B的浓度之比为5∶3B.x=1
C.2min末时,B的浓度为1.5mol/LD.2min末时,A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SiF6(氟硅酸)是一种基本化工原料,广泛用于制取氟硅酸盐及氟化物等。以氟硅酸和碳酸锂等为原料生产电池级LiF的工艺流程如图:
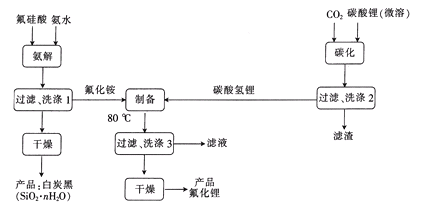
回答下列问题:
(1)生产中采用内衬为聚四氟乙烯或石墨的反应器。聚四氟乙烯的结构简式为____;不用陶瓷设备的原因是____。
(2)“氨解”时发生反应的化学方程式为____,氟化铵的电子式为____。
(3)“碳化”时发生反应的离子方程式为____。
(4)“制备”时产生的气体经分别吸收后返回____和___工序循环使用。
(5)H2SiF6水溶液中存在平衡:SiF62-(aq)+4H2O(1)═Si(OH)4(aq)+4H+(aq)+6F-(aq),该反应的平衡常数表达式为___。
(6)某工厂用纯度为85%的氟硅酸14.4吨和纯度为90%的碳酸锂7.4吨来制备氟化锂,已知流程中氟元素的损耗率为10%,锂元素的损耗率为8%,则最终产品氟化锂为____吨(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________;
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____ (用该氢化物的化学式表示);
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是____(填化学式);
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”);
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”);
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。
M | N | ||
X | Y |
(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为____________________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_______________________________________________________________________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 17 |
化学式 | ___________ | ________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 常温常压下,31 g P4中含P-P键的数目为NA
B. 常温常压下,46 g NO2与92 g N2O4所含的分子数相同
C. 一定条件下,6.4 g铜粉与过量的硫粉充分反应,转移电子数为0.2 NA
D. 标准状况下,将22.4 L Cl2 通入足量NaOH溶液中,转移电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com