
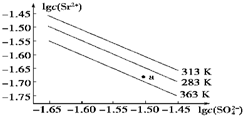
| A. | 温度一定时,Ksp(SrSO4)随c(SO42- )的增大而减小 | |
| B. | 三个不同温度中,313 K时Ksp(SrSO4)最大 | |
| C. | 283 K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
分析 A.Ksp只与温度有关;
B.由图可知,温度越低,Ksp越大;
C.283 K时,图中a点在线下方,增大离子浓度可达到饱和;
D.283K升温到363 K,Ksp减小,有晶体析出.
解答 解:A.Ksp只与温度有关,与浓度无关,故A错误;
B.由图象可知:在相同条件下,温度越低,c(SO42-)•c(Sr2+)越大,所以温度越低时Ksp(SrSO4)越大,故B错误;
C.a点在283K的下方,属于不饱和溶液,故C正确;
D.283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的变化、图象分析为解答的关键,侧重分析与应用能力的考查,注意对数的负值越小时离子浓度越大,题目难度不大.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:1:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
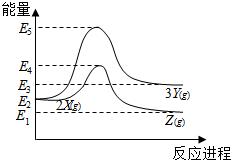
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H>0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
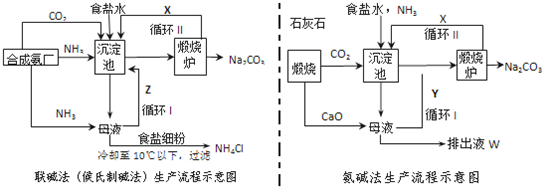
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
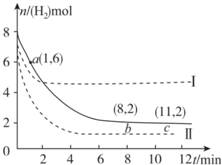
| A. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| B. | 曲线II对应的条件改变是降低压强 | |
| C. | 反应开始至a点时v(H2)=1mol•L-1•min-1 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<$\frac{8}{3}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意图为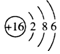 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com