
| X | Y | Z | T | |
| L |
| A. | 原子半径:X<Y<Z<T<L | |
| B. | 气态氢化物的还原性:L>Z>T | |
| C. | 含x的两种盐溶液混合可能生成沉淀 | |
| D. | Y的含氧酸的酸性小于T的含氧酸 |
分析 主族元素中常温常压下单质呈液态的L为溴,则T为Cl、Z为S、Y为Si、X为Al,
A、根据电子层越多,原子半径越多,相同电子层时,核电荷数越大,原子半径越小进行比较;
B.非金属性越强,气态氢化物的还原性越弱;
C.X为Al,偏铝酸根离子和铝离子混合能够反应生成氢氧化铝沉淀;
D.没有指出最高价含氧酸,无法比较两元素含氧酸酸性强弱.
解答 解:L的单质在常温常压下呈液态,且保存时需要用水液封,则L为溴,再根据其它元素在周期表中的位置可以推出T为Cl、Z为S、Y为Si、X为Al,
A.L电子层最多,其原子半径增大,其它元素位于同一周期,电子层数相同,核电荷数越大,原子半径越小,则原子半径大小关系为T<Z<Y<X<L,故A错误;
B.L、Z、T分别为Br、S、Cl,它们的非极性强酸为Cl>Br>S,非金属性越强,气态氢化物的还原性越弱,所以气态氢化物的还原性大小关系为Z>L>T,故B错误;
C.X为Al,铝的盐溶液偏铝酸钠和氯化铝能够反应生成氢氧化铝沉淀,故C正确;
D.Y的最高价含氧酸的酸性小于T的含氧酸,没有指出最高价,该关系不一定成立,故D错误;
故选C.
点评 本题考查了元素周期表与元素周期律综合应用,题目难度中等,注意掌握元素周期表的结构,明确原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都约含有6.02×1023个原子 | |
| B. | 物质的量为2mol的BaCl2中,含有Cl-个数为2NA | |
| C. | O2的摩尔质量是32 | |
| D. | 摩尔是物质的量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 己知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则水电离的热化学方程式为:H2O(l)?H+ (aq)+OH-(aq)△H=+57.3 kJ•mol-1 | |
| D. | 向0.1mol/L的CH3COONa溶液中加入少量醋酸钠固体,c(CH3COO-)/c(Na+ )变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯蔗糖(C12H19Cl3O8)属于天然的糖类甜味剂 | |
| B. | 未成熟的青苹果肉遇碘酒变蓝色,成熟苹果的汁能发生银镜反应 | |
| C. | 利用盐析的方法可以用来分离、提纯蛋白质 | |
| D. | 酚醛树脂、合成橡胶、有机玻璃都属于有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=7的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 由强酸和强碱等物质的量反应得到的物质 | |
| D. | c (H+)=c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应掉的三种金属的质量相等 | B. | 反应后三种金属质量相等 | ||
| C. | 所用盐酸均过量 | D. | 三种金属可以都有剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
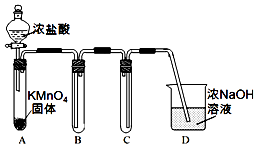 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | V1mL | V2mL | V3mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | V4mL | 3mL | 0mL |
| 硫酸(6mol/L) | V5mL | 2mL | V6mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 相应实验现象 | 结论或推论 | |
| A | 溴水中加入苯,充分振荡、静置 | 水层几乎呈无色 | 苯与溴发生了反应 |
| B | 一小粒金属钠投入装有无水乙醇的试管中 | 反应结束前一段时间,钠浮在乙醇表面 | 密度:乙醇大于钠 |
| C | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液和AgNO3溶液 | a中溶液变蓝,b中产生黄色沉淀 | KI3溶液中存在:I3-?I2+I- |
| D | 分别向含Mn2+的草酸溶液X和不含Mn2+的草酸溶液Y中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液在X溶液中褪色较快 | Mn2+也能还原高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com