
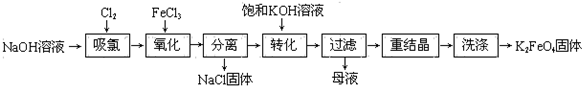
分析 根据流程,向氢氧化钠中通入氯气,可以得到次氯酸钠溶液,向其中加入氯化铁,次氯酸钠可以将之氧化,3NaClO+2FeCl3+10NaOH=2Na2FeO4↓+9NaCl+5H2O,分离出氯化钠后,即可得到高铁酸钠,向其中加入饱和氢氧化钾溶液,发生反应Na2FeO4+2KOH=K2FeO4+2NaOH,可以得到高铁酸钾,经重结晶,洗涤后得K2FeO4,
(1)①在温度较高时NaOH 与Cl2 反应生成氯酸钠和氯化钠,根据反应中转移电子数目可计算得Cl2 的物质的量;
②“吸氯”阶段为了使Cl2尽可能被NaOH溶液吸收完全,可以适当增大NaOH 溶液浓度、缓慢通入氯气、增大氯气与溶液的接触面积;
(2)“氧化”阶段制备Na2FeO4时,为使NaClO能将FeCl3充分氧化,必须保持较高 的浓度,所以在搅拌下,将FeCl3饱和溶液缓慢滴加到NaClO饱和溶液中;
(3)“转化”过程是Na2FeO4和KOH反应生成K2FeO4,根据元素守恒书写反应的化学方程式;
(4)“洗涤”工序中为防止K2FeO4溶解而造成损失,所以不用水而采用异丙醇,同时异丙醇能挥发,洗涤后易干燥;
(5)根据反应:Cl2+2OH-=Cl-+ClO-+H2O、3NaClO+2FeCl3+10NaOH=2Na2FeO4↓+9NaCl+5H2O、Na2FeO4+2KOH=K2FeO4↓+2NaOH,可得关系式Cl2~NaClO~$\frac{2}{3}$Na2FeO4~$\frac{2}{3}$K2FeO4,根据Cl2的质量可计算出K2FeO4固体的质量;
解答 解:根据流程,向氢氧化钠中通入氯气,可以得到次氯酸钠溶液,向其中加入氯化铁,次氯酸钠可以将之氧化,3NaClO+2FeCl3+10NaOH=2Na2FeO4↓+9NaCl+5H2O,分离出氯化钠后,即可得到高铁酸钠,向其中加入饱和氢氧化钾溶液,发生反应Na2FeO4+2KOH=K2FeO4+2NaOH,可以得到高铁酸钾,经重结晶,洗涤后得K2FeO4,
(1)①在温度较高时NaOH 与Cl2 反应生成氯酸钠和氯化钠,反应方程式为3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaClO3+5NaCl+3H2O,在反应中每转移5mol电子,有3mol氯气参加反应,所以每转移1mol电子参加反应的Cl2是0.6mol,
故答案为:3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaClO3+5NaCl+3H2O;0.6;
②“吸氯”阶段为了使Cl2尽可能被NaOH溶液吸收完全,可以适当增大NaOH 溶液浓度、缓慢通入氯气、增大氯气与溶液的接触面积,
故答案为:适当增大NaOH 溶液浓度、缓慢通入氯气、增大氯气与溶液的接触面积;
(2)“氧化”阶段制备Na2FeO4时,为使NaClO能将FeCl3充分氧化,必须保持较高 的浓度,所以在搅拌下,将FeCl3饱和溶液缓慢滴加到NaClO饱和溶液中,
故答案为:在搅拌下,将FeCl3饱和溶液缓慢滴加到NaClO饱和溶液中;
(3)“转化”过程是Na2FeO4和KOH反应生成K2FeO4,反应的化学方程式为Na2FeO4+2KOH=K2FeO4↓+2NaOH,
故答案为:Na2FeO4+2KOH=K2FeO4↓+2NaOH;
(4)“洗涤”工序中为防止K2FeO4溶解而造成损失,所以不用水而采用异丙醇,同时异丙醇能挥发,洗涤后易干燥,
故答案为:防止K2FeO4溶解或分解而损耗、洗涤后易干燥;
(5)根据反应:Cl2+2OH-=Cl-+ClO-+H2O、3NaClO+2FeCl3+10NaOH=2Na2FeO4↓+9NaCl+5H2O、Na2FeO4+2KOH=K2FeO4↓+2NaOH,可得关系式Cl2~NaClO~$\frac{2}{3}$Na2FeO4~$\frac{2}{3}$K2FeO4,35.5tCl2的物质的量为$\frac{35.5×1{0}^{6}}{71}$mol=5×105mol,根据关系式可知K2FeO4固体的物质的量为$\frac{2}{3}$×5×105mol×40%,其质量为$\frac{2}{3}$×5×105mol×198g/mol×40%=26.4t,
故答案为:26.4.
点评 考查考查物质的制备方案的设计、根据方程式计算等知识,题目难度中等,解答本题时注意把握题给信息,学习中注重知识迁移能力的培养.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
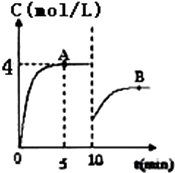 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42ˉ+4H+ | B. | Cl2+SO2+2H2O═H2SO4+2HCl | ||
| C. | 2 Fe3++2Cl-═2 Fe2++Cl2↑ | D. | 2 Fe2++I2═2 Fe3++2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IBr跟水的反应是非氧化还原反应 | |
| B. | 在很多反应中,IBr是强氧化剂 | |
| C. | IBr是共价化合物 | |
| D. | IBr跟NaOH稀溶液反应生成NaI、NaBrO和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 | B. | 32 g•mol-1 | C. | 64 g•mol-1 | D. | 64 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com