
【题目】![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 的
的![]() 水溶液中含有的氧原子数为
水溶液中含有的氧原子数为![]()
B.12g金刚石中含有碳碳键的个数为![]()
C.![]() 时
时![]() 的NaOH溶液中含有
的NaOH溶液中含有![]() 的数目为
的数目为![]()
D.1mol的甲基与1mol的铵银离子所含电子数均为![]()
科目:高中化学 来源: 题型:
【题目】常温下,在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示![]() 因逸出未画出,忽略因气体逸出引起的溶液体积变化
因逸出未画出,忽略因气体逸出引起的溶液体积变化![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
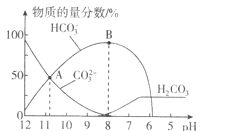
A.在![]() 溶液中:
溶液中:![]()
B.当溶液的pH为7时,溶液的总体积为![]()
C.在B点所示的溶液中,离子浓度最大的是![]()
D.在A点所示的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HClO4、H2SO4、HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋酸中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4![]() 2H++
2H++![]()
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中,发生反应A(g)+B(g) ![]() 2C(g)+D(s) △H=-akJ·mol-1,有关实验内容和结果分别如表和如图所示。下列说法正确的是( )
2C(g)+D(s) △H=-akJ·mol-1,有关实验内容和结果分别如表和如图所示。下列说法正确的是( )
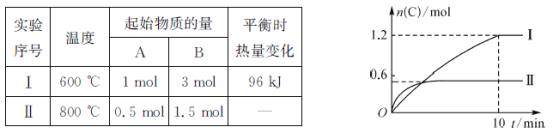
A.实验I中,10 min内平均速率υ(B)=0.06mol·L-1·min-1
B.600℃时,上述热化学方程式中a=160
C.600℃时,该反应的平衡常数K=0.45
D.向实验II的平衡体系中再充入0.5molA和1.5molB,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法正确的是( )

A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列判断中正确的是

A. 用装置①模拟研究时未见a上有气泡产生,说明铁棒没有被腐蚀
B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C. ③中采用了牺牲阳极的阴极保护法保护桥墩
D. ①②③中海水均是实现化学能转化为电能的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向30 mL 0.1 mol·L1 H2A溶液中逐滴加入等浓度NaOH溶液时pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系(如图所示),下列说法错误的是
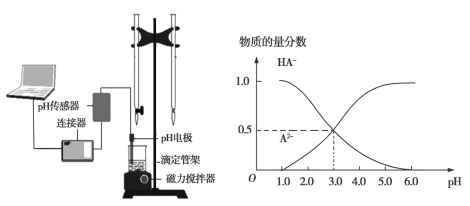
A. pH=4.0时,溶液中n(HA)约为2.73×104 mol
B. 该实验应将左边的酸式滴定管换成右边碱式滴定管
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. 0.1 mol·L1NaHA溶液中存在c(A2)+c(HA)+c(H2A)=0.1 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,量取![]() 的两种二元酸
的两种二元酸![]() 与
与![]() 各
各![]() ,分别加水稀释,测得pH与加水稀释倍数有如图所示关系,则下列有关叙述不正确的是
,分别加水稀释,测得pH与加水稀释倍数有如图所示关系,则下列有关叙述不正确的是

A.![]() 为弱酸
为弱酸
B.NaHA水溶液中:![]()
C.含等物质的量的NaHA、NaHB的混合溶液中:![]()
D.![]() 的NaHB溶液中:
的NaHB溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, 在pH都等于5的NH4Cl和CH3COOH两种溶液中,设由水电离产生的H+ 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
A. A < B B. A = 10-4 B C. B = 10-4 A D. A = B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com