
“嫦娥一号”成功发射,标志着我国实施绕月探测工程迈出重要一步.其任务之一是探测月球土壤厚度、探明氦(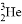 )储量.下列有关氦﹣3(
)储量.下列有关氦﹣3(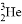 )的说法中正确的是( )
)的说法中正确的是( )
A. 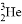 原子核内含有2个中子
原子核内含有2个中子
B. 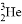 原子核内含有3个质子
原子核内含有3个质子
C. 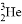 原子核外有3个电子
原子核外有3个电子
D. 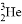 和
和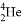 是两种不同的核素
是两种不同的核素
科目:高中化学 来源:2015-2016学年河南省高一下学期5月月考化学试卷(解析版) 题型:选择题
a、b、c、d四个金属电极,有关的实验装置现象如表所示:由此判断这四个电极对应的金属活动性由强到弱的顺序为 ( )
装置 | CuSO4溶液 | 稀硫酸 | 稀硫酸 |
现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
A.d>a>b>c B.b>c>d>a C.a>b>c>d D.a>b>d>c
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下学期期中化学试卷(解析版) 题型:实验题
乙醇的沸点是78 ℃,能与水以任意比混溶,易与氯化钙结合生成配合物。乙醚的沸点为34.6 ℃,难溶于水,乙醚极易燃烧。实验室制乙醚的反应原理是:
2CH3CH2OH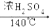 CH3CH2—O—CH2CH3 (乙醚)+H2O
CH3CH2—O—CH2CH3 (乙醚)+H2O
实验步骤:
Ⅰ.乙醚的制备
在分液漏斗中加入2 mL 95%的乙醇,在一干燥的三颈烧瓶中放入12 mL 95%的乙醇,在冷水浴中的冷却下边摇动边缓慢加入12 mL浓硫酸,使混合均匀,并加入2粒沸石。实验装置如下图:
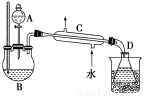
将反应瓶放在电热套上加热,使温度迅速地上升到140 ℃,开始由分液漏斗慢慢滴加乙醇,控制流速并保持温度在135~140 ℃之间。待乙醇加完后,继续反应10 min,直到温度上升到160 ℃止。关闭热源,停止反应。
Ⅱ.乙醚的精制
将馏出物倒入分液漏斗中,依次用8 mL 15% NaOH溶液、8 mL饱和食盐水洗涤,最后再用8 mL饱和氯化钙溶液洗涤2次,充分静置后分液。将乙醚倒入干燥的锥形瓶中,用块状无水氯化钙干燥。待乙醚干燥后,加入到蒸馏装置中用热水浴蒸馏,收集33~38 ℃的馏分。
请根据上述信息,完成下列问题:
(1)乙醚的制备和精制过程中都需要使用沸石,其作用是________________________,
如果实验中忘记加沸石,需要怎么处理?______________________________________。
(2)乙醚的制备和精制过程中都需要使用温度计,其水银球位置是否相同?________(填“是”或“否”),原因是_____________________________________________________________。
(3)仪器C的名称为________。
(4)如果温度太高,将会发生副反应,产物是__________。
(5)精制乙醚中,加入15% NaOH溶液的作用是_________,加入饱和氯化钙溶液的作用是_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
用过量的锌与稀硫酸反应制H2时,下列能减缓反应速率但又不影响生成氢气总量的是( )
A. 加入少量Na2CO3固体 B. 加入少量CuSO4溶液
C. 加入少量NaOH固体 D. 加水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
对于反应N2 +3H2 2NH3 △H <0,下列肯定不是该反应达到平衡状态的标志是( )
2NH3 △H <0,下列肯定不是该反应达到平衡状态的标志是( )
A.断开一个N≡N,同时有六个N-H键生成
B.生成氨的速率与分解氨的速率相等
C. N2 、H2,、NH3的质量分数不再变化
D.混合气体总压不再改变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高二下学期期中考试化学试卷(解析版) 题型:填空题
元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式______________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物的化学式分别是________,其中最不稳定的是________。
(3)它们的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的化学式________,电子式________,结构式________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高二下学期期中考试化学试卷(解析版) 题型:选择题
下列化合物的核磁共振氢谱中出现三组峰的是( )
A. 2,2,3,3?四甲基丁烷
B. 2,3,4?三甲基戊烷
C. 3,4?二甲基己烷
D. 2,5?二甲基己烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:实验题
乙醛在氧化铜催化下,可以被空气氧化成乙酸。依据此原理设计验证实验(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水用于收集少量乙酸溶液;烧杯B中装有某液体)。已知在60℃~80℃时,用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:

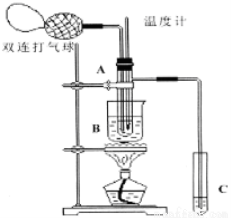
请回答下列问题:
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件) ;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在 ,目的是 ;
(3)烧杯B的作用是 ;烧杯B内盛装的液体可以是 或 (在上表中物质里选择,填写结构简式);
(4)若想检验试管C中是否含有产物乙酸,请你在下列药品中进行选择,设计一个简便的实验方法。可供选择的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方法为________ ;
(5)已知乙醛能被溴水氧化,写出该反应的化学方程式______________________________ .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:实验题
海洋资源的利用具有广阔前景.
(1)如图是从海水中提取镁的简单流程。
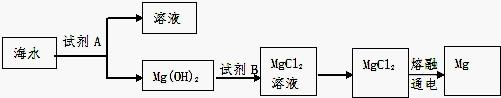
①工业上常用于沉淀Mg2+的试剂A是 ,Mg(OH)2转化为MgCl2的离子方程式是 。
②由无水MgCl2制取Mg的化学方程式是 。
(2)海带灰中富含以I﹣形式存在的碘元素.实验室提取I2的途径如下所示:
干海带 海带灰
海带灰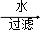 滤液
滤液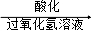
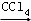
 I2
I2
①灼烧海带至灰烬时所用的主要仪器名称是 。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式 。
③反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图:
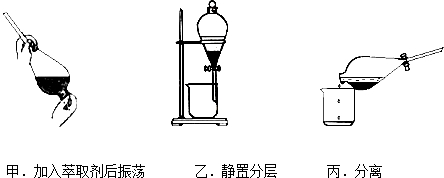
甲、乙、丙3步实验操作中,不正确的是 (填“甲”、“乙”或“丙”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com