
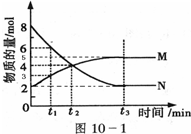
 Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切? M;结合v=
M;结合v=| △c |
| △t |
| △c |
| △t |
| ||
| 2min |
| 8mol-2mol |
| 8ml |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
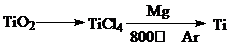
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 丁达尔效应是区分胶体与溶液的一种最常用的方法.
丁达尔效应是区分胶体与溶液的一种最常用的方法.查看答案和解析>>
科目:高中化学 来源: 题型:
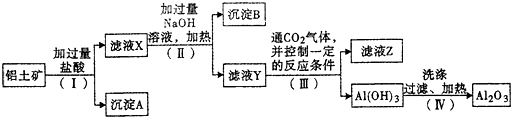
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
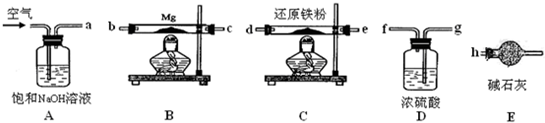
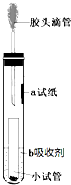 一位同学设计了一套微型装置(如图),用来完成下列实验.
一位同学设计了一套微型装置(如图),用来完成下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中溶液能电离出自由移动的离子 |
| B、有导线将两个活动性不同的电极连接 |
| C、正极发生了氧化反应,而负极发生了还原反应 |
| D、两电极上分别进行的氧化、还原反应中会有电子的转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 喷泉是一种常见的自然现象,如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体;下列气体和液体的组合中不可能形成喷泉的是( )
喷泉是一种常见的自然现象,如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体;下列气体和液体的组合中不可能形成喷泉的是( )| A、HCl和H2O |
| B、O2和H2O |
| C、NH3和H2O |
| D、CO2和NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com