
| A、常温下1.0L 0.1mol?L-1NH4Cl溶液中,NH4+和H+总数大于0.1NA | B、常温下,11.2L乙烯在氧气中完全燃烧转移的电子数为6.0NA | C、88.0g干冰中含有的电子对数为8.0NA | D、1.2g金刚石中含有的碳碳键数为0.4NA |
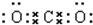 ,所以二氧化碳分子中存在8对电子对;
,所以二氧化碳分子中存在8对电子对;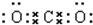 可知,2mol二氧化碳中含有16mol电子对,含有的电子对数为16NA,故C错误;
可知,2mol二氧化碳中含有16mol电子对,含有的电子对数为16NA,故C错误;| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、只有① | B、①② |
| C、②③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°C时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | ||
| B、室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA | ||
C、1L 0.5mol?L-1 的(NH4)2SO4溶液中含有的N
| ||
| D、标准状况下,22.4LCCl4中含有的共用电子对数目为4.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1mol?L-1的氨水中有NA个NH4+ | B、常温常压下,8g O2含有4NA个电子 | C、标准状况下,22.4L三氯甲烷含有NA个分子 | D、1mol Na被完全氧化生成Na2O2,失去2NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个N2分子与0.5NA个H2分子所占的体积比一定是2:1 | B、相同物质的量的OH-和CH3+含有相同数目的电子 | C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | D、常温常压下,NO2与足量H2O反应生成0.1mol NO,则转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol铝与足量烧碱溶液反应时,被还原的水分子数目为2NA | B、常温下,pH=11的氨水中OH-数目为1×10-3NA | C、1mol明矾与水反应完全转化为氢氧化铝胶体后,胶体粒子的数目为NA | D、常温常压下,2gD216O中含中子数、质子数、电子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,30L pH=ll的Na2CO3溶液中含有的OH-数为0.03NA | B、用含有0.1mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA | C、25℃时,PH=13的1L Ba(OH)2溶液中含有的OH-数为0.2NA | D、100mL 12mol?L-1浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol NaHS04晶体中含有2NA个离子 | B、将FeCl3的饱和溶液(含FeCl3 0.1mol)加入沸水中充分作用制成胶体,其中含有胶体粒子的数目为0.1NA | C、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA | D、pH=2的硫酸中H+离子的数目为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA | ||
| B、标准状况下,11.2L氨气溶于水配制成500mL溶液,溶液中NH4+数目为0.5NA | ||
C、1molD
| ||
| D、7.8gNa2O2中含有的阴离子总数等于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com