
【题目】已知X,Y,Z,W(含同一元素)有如转化关系,若X是一种单质,W为一种含氧酸,则X不可能是( )
X ![]() Y
Y ![]() Z
Z ![]() W.
W.
A.N2
B.C
C.S
D.Si
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:
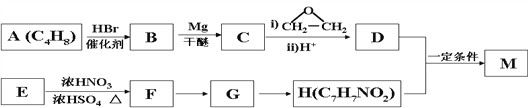
已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
②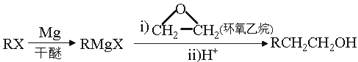 。
。
③E为芳香烃,其相对分子质量为92。④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是__________。
(2)由E生成F的化学方程式为__________________。
(3)由G生成H的反应类型为__________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_________种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________________。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,设计合成路线 ___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol/L,则此时v(正)<v(逆)
C. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D. 恒温时将气体体积缩小到原来的一半,达到新平衡时CO浓度将要减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。已知:
①H2(g)+Cl2(g)=2HCl(g) ΔH=-a ![]()
②E(H-H)=b![]() , E(Cl-Cl)=c
, E(Cl-Cl)=c ![]()
则:E(H-Cl)=_____________kJ·mol-1。
(2)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热。已知:
①CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H=-a kJ·mol-1
②C(石墨)+O2(g)==CO2(g) △H=-b kJ·mol-1
③H2(g)+1/2O2(g)==H2O(l) △H=-c kJ·mol-1
则反应C(石墨)+2H2(g) → CH4(g)的反应热△H=________kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) ![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是____(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是____。
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1molCO2生成的同时有3mol H-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是____________。
(3)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) 其平衡常数表达式为_____________________________。
CH4(g)+2H2O(g) 其平衡常数表达式为_____________________________。
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L一1,H2:0.8 mol·L一1,CH4:0.8 mol·L一1,
H2O:1.6 mol·L一1。
则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=___________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____ O (填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列与NA有关的说法正确的是
A. 12g金刚石中含有的共价键数为4NA
B. S2和S8的混合物共64 g,其中所含硫原子数—定为2NA
C. 60gSiO2晶体中含有Si-O键数目为2NA
D. 44g干冰晶胞( )含有的CO2分子个数为14NA
)含有的CO2分子个数为14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被HNO3溶解,反应方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式
(2)上述反应中,氧化剂是 , 氧化产物是 .
(3)每2molCu参加反应,转移的电子个,在反应的硝酸中没有参加氧化还原反应的硝酸占总硝酸的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类
A、75%的酒精溶液 B、硝酸钠
C、Fe(OH)3胶体 D、豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空:
(1)实验室中可用KClO3和浓HCl反应制取氯气,写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目;该反应中,氧化产物是 , 还原产物是 , 氧化产物与还原产物的物质的量之比是 .
(2)化学镀镍的溶液中含有Ni2+和H2PO2﹣在酸性条件下发生如下反应,请配平该反应.
Ni2++H2PO2﹣+→ Ni++H2PO3﹣+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com