
| A、a+b>c |
| B、a+b>2c |
| C、a+b<c |
| D、a+b<2c |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
| A、0.1 mol?L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| B、在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 |
| C、0.1 mol?L-1与0.2 mol?L-1氨水溶液中c(OH-)之比为1:2 |
| D、中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是分解反应 |
| B、是氧化还原反应 |
| C、反应中碳元素的化合价降低 |
| D、氧化剂是C2H3N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
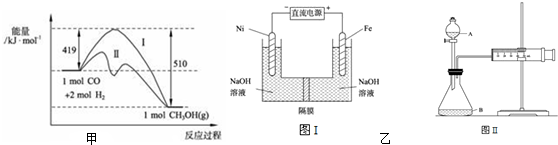
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn |
| B、碳棒 |
| C、MnO2和NH4+ |
| D、Zn2+和NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.21 mol/L |
| B、0.42 mol/L |
| C、0.56 mol/L |
| D、0.24 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=2:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com