
|
用稀硫酸、NaOH溶液、Al为原料制取Al(OH)3,甲、乙、丙3个学生分别用3种不同途径: 甲 :Al乙 :Al
制得等量 Al(OH)3,下列结论正确的是 | |
| [ ] | |
A. |
甲用原料最少 |
B. |
乙用原料最少 |
C. |
丙用原料最少 |
D. |
三人用原料的量相同 |
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 2n-7 |
| 2n+1 |
| 2n-7 |
| 2n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 预期现象和结论 | 步骤1:取适量牙膏样品加水充分搅拌、过滤,得滤液A和沉淀B. | / | 步骤2:取适量滤液A于试管中, |
有 |
步骤3:取适量沉淀B于试管中,加入过量 |
/ | 步骤4:往所得滤液中通入过量二氧化碳. | 产生成白色沉淀, |
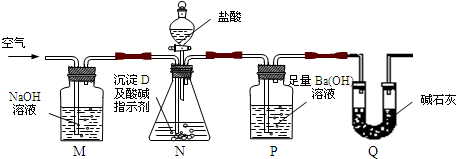
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B. | / |
| 步骤2: |
|
| 步骤3: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com