
| 20g |
| 100g/mol |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、患口腔溃疡时可服用维生素B2,它存在于牛奶和蛋黄等食物中 |
| B、多吃胡萝卜,可预防夜盲症,因其中含有丰富的维生素A |
| C、维生素C具有止血功能,所以被称为抗坏血酸 |
| D、维生素K是凝血酶元的主要成分,它是止血的功臣 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下
| ||
| B、加Zn能放出H2的溶液:Mg2+、SO42-、Cl-、HCO3- | ||
| C、含有较多Fe3+的溶液:Na+、H+、Cl-、SO42- | ||
| D、滴入KSCN溶液呈红色的溶液:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Ag(NH3)2]+、K+、OH-、 |
| B、Fe3+、Cl-、I- |
| C、H+、Al3+、F- |
| D、ClO-、Na+、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
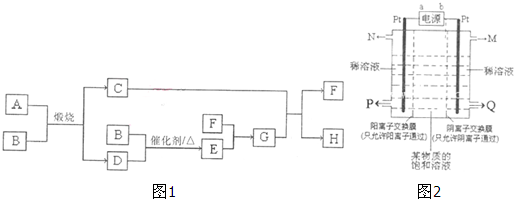
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
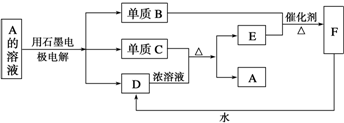
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.7 g |
| B、7.8 g |
| C、16.5 g |
| D、4.0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com