
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
【答案】BD
【解析】
A.从开始至平衡时,时间未知,不能计算容器Ⅰ中SO3的反应速率,故A错误;
B.I与Ⅱ温度相同,I中起始量为II中2倍,该反应为气体体积减小的反应,增大压强平衡正向移动,则平衡时,容器Ⅱ中SO3的浓度小于0.022molL-1,故B正确;
C.I与Ⅲ起始量相同,该反应为放热反应,升高温度平衡逆向移动,则平衡时,容器Ⅲ中SO3的浓度小于0.044molL-1,故C错误;
D. 2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
开始(mol) 0.2 0.1 0
转化(mol)0.044 0.022 0.044
平衡(mol)0.156 0.078 0.044
K=0.0442/0.078×0.1562=1.02,若起始时,向容器Ⅰ中充入0.02molSO2,0.01molO2和0.02molSO3,Qc=0.022/0.022×0.01=100>K,则反应向逆反应方向进行,故D正确。
故选BD。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式:________。
(2)根据等电子原理,写出CO分子的结构式__________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醛分子中碳原子轨道的杂化类型为_______________。
②甲醛分子的空间构型是___________;1 mol甲醛分子中σ键的数目为______________。
③在1个Cu2O晶胞(结构如图所示)中,所包含的Cu原子数目为______________。
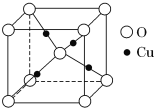
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E 都含X元素,其转化关系如下图所示。

(1)请分别写出A、B、C、D、E的化学式(如为溶液请填溶质的化学式):
A _____,B _____,C ______,D_____,E___________。
(2)写出下列反应的化学方程式:
A+H2O:______________;
A+NaOH:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于焓变(ΔH)的叙述或判断中错误的是

A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的 ΔH<0
B. 500 ℃、30 MPa下,0.5 mol N2和1.5 mol H2充分反应放出 19.3 kJ 热量,则反应“N2(g)+3H2(g) ![]() 2NH3(g)”的 ΔH=-38.6 kJ·mol-1
2NH3(g)”的 ΔH=-38.6 kJ·mol-1
C. 据下图1 知:ΔH1 = ΔH2+ΔH3
D. 据下图2 知:E的大小对该反应的ΔH 无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.6g H2O的物质的量是________,含有________个H2O,含有________molH。
(2)0.1molAl2(SO4)3中含有Al3+________mol、SO42- ________个。
(3)2 mol O3和3mol O2的质量之比为__________。
(4)9.5gMgCl2固体溶于水配成500mL溶液,浓度为______molL1,从中取出100mL溶液,其中Cl的浓度为_____molL1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为______molL1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Mg2+、Ba2+ 、Ag+和NO3-,现分别用NaCl溶液、NaOH溶液和Na2CO3溶液将溶液中三种阳离子逐一完全沉淀分离,其流程如右图所示。下列说法正确的是( )

A. 试剂A可能为NaOH溶液
B. 沉淀2只能是BaCO3 ,不可能是Mg(OH)2
C. 每加一种试剂需过量但不需要过滤即可进行下一步
D. 生成沉淀1的离子方程式只能是:Ag+ + Cl- = AgCl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯分子中碳碳键的长度完全相等
③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷(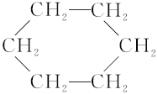 )
)
④经实验测得对二甲苯(![]() )只有一种结构
)只有一种结构
⑤苯在溴化铁作催化剂条件下同液溴可发生取代反应,但不能因化学反应而使溴水褪色
A. ②③④B. ②④⑤C. ①③⑤D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子的核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第____族。W的气态氢化物稳定性比H2O(g)_______(填“强”或“弱”)。
(2)Y的基态原子的核外电子排布式是______, Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com