
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子反应方程式 | |
| ①Fe(Al) | ||
| ②FeCl 2溶液(FeCl3) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中阳离子半径大于阴离子半径 | |
| C. | 跟液氨反应时,生成氢气外,还生成铵盐 | |
| D. | 与乙醇反应时,放出氢气的速率比与水反应时更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
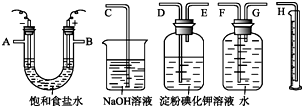 请用如图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置.(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)
请用如图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置.(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
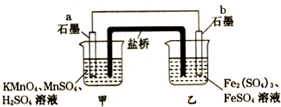 设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )
设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )| A. | 外电路电子的流向是从a到b | |
| B. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| C. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| D. | 双液原电池工作时产生大量的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
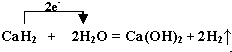 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
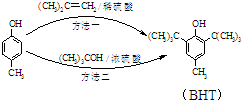 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从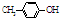 出发合成BHT的方法有如图两种.下列说法错误的是
出发合成BHT的方法有如图两种.下列说法错误的是| A. | BHT与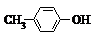 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| B. | BHT在水中的溶解度小于苯酚 | |
| C. | 两种方法的反应类型都是加成反应 | |
| D. | 从绿色化学角度分析方法一优于方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com