
| L/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| c2(Z) |
| c(X)?c(Y) |
| c2(Z) |
| c(X)?c(Y) |
| △c |
| △t |
| 生成物平衡你的幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| c2(Z) |
| c(X)?c(Y) |
| △c |
| △t |
| (1.100-1.075)mol |
| 10L×(6-4)min |
| 生成物平衡你的幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.12 2 |
| 0.1×0.1 |


科目:高中化学 来源: 题型:
| A、CH3Cl+Cl2→CH2Cl2+HCl |
| B、CH3-CH=CH2+Br2─→CH3-CHBr-CH2Br |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与水反应 |
| B、能与氢氧化钠溶液反应 |
| C、能与硫酸反应 |
| D、能与碳酸钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,试回答:
,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与W相邻的同主族元素单质的重要用途是制作光纤 |
| B、X单质不可能置换出W单质 |
| C、元素原子半径从大到小的顺序是X、Y、Z |
| D、由非金属性强弱可知,不可能由W的含氧酸制备Z的含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
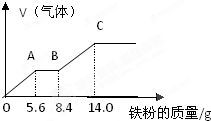 某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)
某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com