

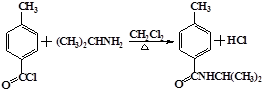 .
. .
.分析 (1)A含有官能团羧基,应从与羧基相连的碳为起点给苯环上的C原则开始编号,甲基位于4号C,据此写出其名称;根据丙卡巴肼的结构简式写出其分子式;
(2)在二氯甲烷、加热条件下,有机物B中的氯原子被(CH3)2CHNHNH2中的-NHNHCH(CH3)2取代生成有机物C和HCl;
(3)a.有机物D中含有溴原子、肽键,可发生水解反应;
b.有机物E不含酯基;
c.有机物F为盐类,水解呈酸性;
d.有机物G中存在氨气分子三角锥结构,所有碳原子不一定在同一平面上;
(4)HCOOH与足量新制的氢氧化铜反应生成二氧化碳、氧化亚铜与水;
(5)有机物B的结构简式为: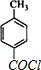 ,其同分异构体能发生银镜反应,说明含有醛基;苯环上的一取代物只有两种,说明苯环上有两个不同取代基且位于相对位置,两个取代基为-CHO和-CH2Cl或-CH2CHO和-Cl.
,其同分异构体能发生银镜反应,说明含有醛基;苯环上的一取代物只有两种,说明苯环上有两个不同取代基且位于相对位置,两个取代基为-CHO和-CH2Cl或-CH2CHO和-Cl.
解答 解:(1)A含有官能团羧基,应从与羧基相连的碳为起点给苯环上的C原则开始编号,甲基位于4号C,则其名称为:4-甲基苯甲酸
根据丙卡巴肼的结构简式可知,其分子式为:C12H19N3O;
故答案为:4-甲基苯甲酸;C12H19N3O;
(2)在二氯甲烷、加热条件下,有机物B中的氯原子被(CH3)2CHNHNH2中的-NHNHCH(CH3)2取代生成有机物C和HCl,反应方程式为: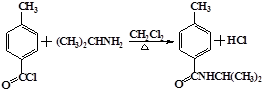 ,
,
故答案为: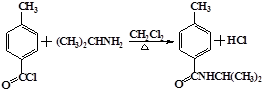 ;
;
(3)a.有机物D中含有溴原子、肽键,可发生水解反应,故a正确;
b.有机物E不含酯基,含有肽键,故b错误;
c.有机物F为盐类,水解呈酸性,故c正确;
d.有机物G中存在氨气分子三角锥结构,所有碳原子不一定在同一平面上,故d错误,
故选:ac;
(4)HCOOH与足量新制的氢氧化铜反应生成二氧化碳、氧化亚铜与水,反应方程式为:HCHO+4Cu(OH)2$\stackrel{△}{→}$CO2↑+2Cu2O↓+5H2O,
故答案为:HCHO+4Cu(OH)2$\stackrel{△}{→}$CO2↑+2Cu2O↓+5H2O;
(5)有机物B的结构简式为: ,其同分异构体能发生银镜反应,说明含有醛基;苯环上的一取代物只有两种,说明苯环上有两个不同取代基且位于相对位置,两个取代基为-CHO和-CH2Cl或-CH2CHO和-Cl,则满足条件的有机物B的同分异构体的结构简式为
,其同分异构体能发生银镜反应,说明含有醛基;苯环上的一取代物只有两种,说明苯环上有两个不同取代基且位于相对位置,两个取代基为-CHO和-CH2Cl或-CH2CHO和-Cl,则满足条件的有机物B的同分异构体的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机合成、有机物结构与性质、有机反应方程式书写、限制条件同分异构体书写等,熟练掌握官能团的性质,试题侧重考查学生的分析、理解能力.


科目:高中化学 来源: 题型:解答题
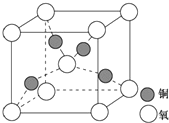 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:W<Z | |
| B. | 气态氢化物的稳定性:W>Z | |
| C. | 简单离子半径:Z>W>X>Y | |
| D. | X的氢化物中不可能含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 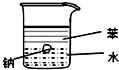 证明密度ρ(苯)<ρ(钠)<ρ(水) | B. | 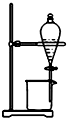 分离酒精和四氯化碳 | ||
| C. | 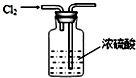 干燥Cl2 | D. | 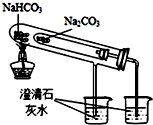 比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车催化转化器中尾气处理反应的化学方程式为CO+NO$\frac{\underline{\;\;△\;\;}}{\;}$C+NO2 | |
| B. | 铁红溶于足量氢碘酸的离子方程式为Fe2O3+6H+═2Fe3++3H2O | |
| C. | 加入铝粉能产生氢气的溶液中可能存在大量的:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中可能存在大量的:Na+、Fe2+、SO42-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

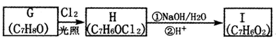
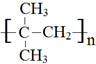 .
.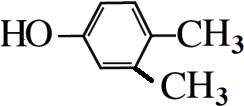 .
.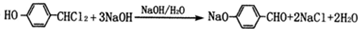 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| B. | 溴苯分子中苯环上的一个氢原子被-C4H9原子团取代形成的同分异构体共有12种 | |
| C. | 乙醇、乙酸、乙酸乙酯都能发生取代反应 | |
| D. | 乙烯、甲烷都不能使溴的四氯化碳溶液和酸性KmnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| C. | Y、Z、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 与KI溶液反应的离子方程式为Fe3++2I-═Fe2++I2 | |
| C. | 与Na2CO3溶液反应的离子方程式为2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| D. | 与Mg(OH)2悬浊液反应的离子方程式为3OH-+Fe3+═Fe(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com