
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | Na+的结构示意图: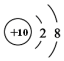 | |
| D. | 赤铁矿的主要成分:Fe3O4 |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E、N、M、P | B. | M、N、P、E | C. | P、M、N、E | D. | P、N、M、E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BeCl2 CO2 | B. | H2O SO2 | C. | BF3 NCl3 | D. | SiCl4 SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 反应速率越大,反应现象就一定越明显 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件).
X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管夹夹试管应从试管底往上套,拇指按在试管夹的短柄上 | |
| B. | 装碘的试剂瓶中残留的碘可以用酒精洗涤 | |
| C. | 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管滴加蒸馏水到刻度线 | |
| D. | 定容时,俯视刻度线,会使所配溶液的浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )
图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )| A. | 分子中含有三种官能团 | |
| B. | 1 mol 该化合物最多能与6 mol NaOH 反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com