
 [化学--选修物质结构与性质]
[化学--选修物质结构与性质]
| ||
| ||
 ,由短周期元素构成的与SO
,由短周期元素构成的与SO2- 4 |
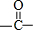 中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于
中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于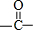 平面内;
平面内;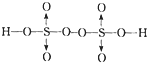 ;
; ;
;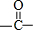 中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于
中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于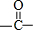 平面内,故H3CCOCH3中,共平面的原子最多有6个(3个C原子、1个O原子、2个H原子),
平面内,故H3CCOCH3中,共平面的原子最多有6个(3个C原子、1个O原子、2个H原子),

科目:高中化学 来源: 题型:
| A、充电时阳极反应为Li++e-=Li |
| B、充电时动力电池上标注“-”的电极应与外接电源的负极相连 |
| C、放电时电池内部Li+向负极移动 |
| D、放电时,在正极上是Li+得电子被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+2H2O |
| D、铁跟稀硫酸反应:Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3水解时的离子方程式:HCO3-+H2O?H3O++CO32- |
| B、AgCl溶于水时形成的溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) |
| C、少量的CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+CO32- |
| D、向NaHSO4溶液中滴加过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:



 ,如果E→H的反应在一定条件下也能实现的话,请你预测所得高分子感光树脂单体H 的最简单的结构简式为
,如果E→H的反应在一定条件下也能实现的话,请你预测所得高分子感光树脂单体H 的最简单的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com