
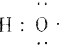 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同

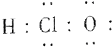
| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5) | D. | (1)(2)(5) |
分析 (1)-OH与 分别为羟基的结构简式和电子式;
分别为羟基的结构简式和电子式;
(2)sp2杂化轨道的空间构型为平面三角形,夹角为120°;
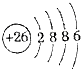
(3)Fe2+有三个电子层,分别容纳2 8 14个电子;
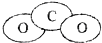
(4)二氧化碳为直线型结构;
(5)丙烷为饱和烷烃,存在碳碳单键和碳氢单键,四个碳原子在一条链上;
(6)次氯酸中氧原子分别与氯原子和氢原子共用1对电子.
解答 解:(1)-OH与 分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故(1)正确;
分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故(1)正确;
(2)sp2杂化轨道的空间构型为平面三角形,夹角为120°,杂化轨道为: ,故(2)正确;
,故(2)正确;
(3)Fe2+有三个电子层,分别容纳2 8 14个电子,故(3)错误;
(4)二氧化碳为直线型结构,其正确的比例模型为: ,故(4)错误;
,故(4)错误;
(5)丙烷为饱和烷烃,存在碳碳单键和碳氢单键,四个碳原子在一条链上,丙烷的球棍模型为: ,故(5)正确;
,故(5)正确;
(6)次氯酸的中心原子为O原子,次氯酸正确的电子式为: ,故(6)错误;
,故(6)错误;
故选D.
点评 本题考查了化学用语的判断,熟悉原子结构示意图、结构简式、结构式、分子模型是解题关键,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中NH4+、Al3+、NO3-、Cl-可以共存 | |
| B. | 氧化镁可以用作耐火材料 | |
| C. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| D. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
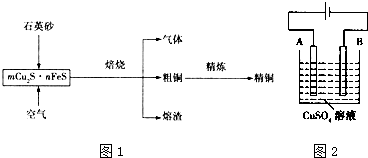
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
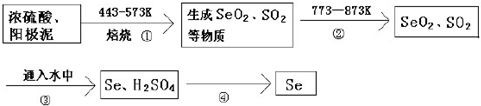
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
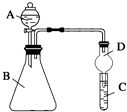 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响 b.实验1和3探究反应物浓度对该反应速率的影响. c.实验2和4探究催化剂对反应速率的影响 | |
| 体积(mL) | 浓度(mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |

| 试验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
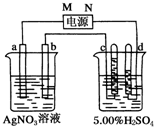 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com