��������1��A�������������������䣬������������䣬���������ܶ�ʼ�ղ��䣻
B����������ܵ����ʵ������䣬����������䣬�ݴ��жϣ�
C���淴Ӧ���У���Ӧ��Ũ�Ƚ��ͣ�����Ӧ�������ͣ�
D���淴Ӧ���У���Ӧ��Ũ�Ƚ��ͣ�����Ӧ�������ͣ��������Ũ�������淴Ӧ�������ʵ�λʱ���ڣ�N
2������������NO������������
��2���ٸ��ݷ�Ӧ����ʽ2NO��g��+2CO��g��
2CO
2��g��+N
2��g����ƽ�ⳣ���ĸ���д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��
���ȸ��ݴﵽƽ��ʱ����ֵ�Ũ�ȼ�������¶��µ�ƽ�ⳣ����Ȼ����ݳ���CO 0.5mol��N
2 0.75mol�����ֵ�Ũ�ȼ����Ũ���̣�����������ƽ�ⳣ����Ƚϣ��Ӷ��жϻ�ѧƽ���Ƿ��ƶ����ƶ�����
��t
4ʱ�����淴Ӧ����ͬʱ��С�������Ǽ�Сѹǿ���߽����¶ȣ�����v���棩��v��������ƽ�����������ƶ���˵���Ǽ�С��ѹǿ��
��3����n��NO����n��NO
2��=1��3����Ӧ���ɲ���Ϊ��������ӣ����ݻ��ϼ����������ƽ�÷�Ӧ�Ļ�ѧ����ʽ��
�ڸ��ݷ�Ӧ����ʽ������������������Ӧ����һ�������Ͷ����������������
���
�⣺��1��A�������������������䣬������������䣬���������ܶȲ��䣬��A����
B����������ܵ����ʵ������䣬����������䣬��������ѹǿ���䣬��B����
C�����ŷ�Ӧ�Ľ��У���Ӧ��Ũ�Ƚ��ͣ�������Ӧ�������ͣ���C��ȷ��
D���淴Ӧ���У���Ӧ��Ũ�Ƚ��ͣ�����Ӧ�������ͣ��������Ũ�������淴Ӧ�������ʵ�λʱ���ڣ�N
2����������С��NO������������λʱ���ڣ�N
2��NO��������֮�ȼ�С������ȷ��
�ʴ�Ϊ��CD��
��2���ٷ�Ӧ����ʽ2NO��g��+2CO��g��
2CO
2��g��+N
2��g���Ļ�ѧƽ�ⳣ������ʽΪ��K=
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
��
�ʴ�Ϊ��
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
��
����5min��ﵽƽ��״̬��CO
2��ƽ����Ӧ����v ��CO
2��=0.1mol?��L?min��
-1����Ӧ���ɶ�����̼��Ũ��Ϊ��0.1mol?��L?min��
-1��5min=0.5mol/L����Ӧ����NO��Ũ��Ϊ��c��NO��=c��CO
2��=0.5mol/L��
����NO��ת����Ϊ��
��100%=25%��
�ﵽƽ��ʱ����ֵ�Ũ�ȷֱ�Ϊ��c��CO
2��=0.5mol/L��c��NO��=
-0.5mol/L=1.5mol/L��c��N
2��=0.25mol/L��c��CO��=
-0.5mol/L=0.5mol/L������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ��K=
=
��
������ƽ��������г���CO 0.5mol��N
2 0.75mol��COŨ�ȱ�Ϊ��c��CO��=0.5mol/L+
=1mol/L��������Ũ��Ϊ��c��N
2��=0.25mol/L+
=1mol/L�����ʱ��Ũ����Ϊ��
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
=1
mol=
=K�����Ի�ѧƽ�ⲻ�����ƶ���
�ʴ�Ϊ��25%������
�۸���ͼ���֪��t
4ʱ�����淴Ӧ���ʶ�ͬʱ��С�������Ǽ�Сѹǿ���߽����¶ȣ��������¶ȣ��÷�Ӧ�����ȷ�Ӧ��ƽ�����������ƶ�����t
4ʱ��v���棩��v��������ƽ�����������ƶ���˵���Ǽ�С��ѹǿ��
�ʴ�Ϊ����Сѹǿ��
��3���������������շ�Ҳ���Գ�ȥNO��������NO�в��������������γ���NO��NO
2��ɵ�������û������n��NO����n��NO
2��=1��3�����������ͨ��ʯ�����У�ʹ֮ת��Ϊ����ƣ���һ������Ϊ1mol�����������Ϊ3mol��1molһ������ת�������������ʧȥ3mol���ӣ�3mol��������ת��������ʧȥ3mol���ӣ��ܹ�ʧȥ6mol���ӣ���Ҫ�������������ʵ���Ϊ
=1.5mol�����ڻ�ѧ����ʽ�в��ܳ��ַ����������������ļ�����Ϊ3��һ�������Ͷ��������ļ������ֱ�Ϊ2��6���÷�Ӧ�Ļ�ѧ����ʽΪ��3O
2+2NO+6NO
2+4Ca��OH��
2=4Ca��NO
3��
2+4H
2O��
�ʴ�Ϊ��3O
2+2NO+6NO
2+4Ca��OH��
2=4Ca��NO
3��
2+4H
2O��
�ڷ�Ӧ����ʽ��3O
2+2NO+6NO
2+4Ca��OH��
2=4Ca��NO
3��
2+4H
2O
3 2 6
33.6mL x y��
��ã�x=22.4mL��y=67.2mL��
���״���µ�O
2 33.6mL�������Ͽ��Դ����õ����������Ϊ��22.4mL+67.2mL=89.6mL��
�ʴ�Ϊ��89.6mL��

 2013�궬�����������������Ű�ҹ�������������������β������ɿ�����Ⱦ��ԭ��֮һ���о���������β����Ϊ������������Ҫ����
2013�궬�����������������Ű�ҹ�������������������β������ɿ�����Ⱦ��ԭ��֮һ���о���������β����Ϊ������������Ҫ����

 ��У����ϵ�д�
��У����ϵ�д�
 �ڱ�������������һ����ʹ�������������ܼ���������Ӱ��̥����Ӥ�����ںɶ��ɷ��ڣ���������ʧ�������¶�ͯ�����죬�ǿ����°�����й����ڱ���������������ṹ��ͼ��ʾ����˵������ȷ���ǣ�������
�ڱ�������������һ����ʹ�������������ܼ���������Ӱ��̥����Ӥ�����ںɶ��ɷ��ڣ���������ʧ�������¶�ͯ�����죬�ǿ����°�����й����ڱ���������������ṹ��ͼ��ʾ����˵������ȷ���ǣ������� ������������ȷ���ǣ�������
������������ȷ���ǣ�������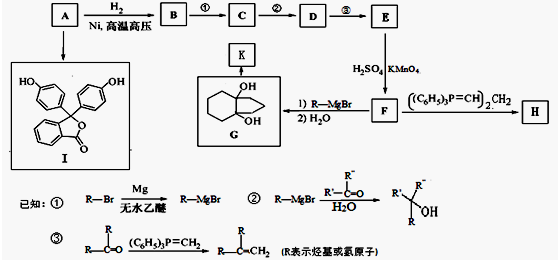
 �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�