
科目:高中化学 来源: 题型:阅读理解
 (2010?四川)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
(2010?四川)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:| 实验方法 | 实验现象及结论 |
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝. 取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝. |
如果不变蓝,说明无I-.(如果变蓝,说明有I-) 如果不变蓝,说明无I-.(如果变蓝,说明有I-) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
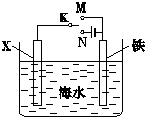 (1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于| 实验方法 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


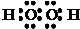
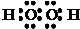
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
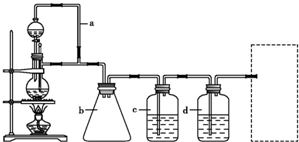 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2SO4 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com