
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
分析 ①乙酸和葡萄糖的最简式均为CH2O,只需要计算30gCH2O中所含氢原子数;
②过氧化钠与水反应为歧化反应,过氧化钠既是氧化剂又是还原剂;
③1L0.1mol•L-1的NaHCO3溶液,碳酸根离子部分水解生成碳酸,部分电离生成碳酸根离子,依据碳原子个数守恒解答;
④依据n=$\frac{V}{Vm}$计算一氯甲烷的物质的量,1个一氯甲烷分子含有3个C-H键;
解答 解:①乙酸和葡萄糖的最简式均为CH2O,30g由乙酸和葡萄糖组成的混合物中含有CH2O物质的量为$\frac{30g}{30g/mol}$=1mol,含有氢原子个数为1mol×2×NA=2NA,故①正确;
②过氧化钠与水反应为歧化反应,过氧化钠既是氧化剂又是还原剂,生成1mol氧气转移2mol电子,则生成0.5molO2时转移电子数为NA,故②正确;
③依据碳原子守恒,1L0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-、H2CO3之和等于0.1NA,1L0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和小于0.1NA,故③正确;
④标准状况下,2.24L的一氯甲烷中含有的碳氢共价键的数目为$\frac{2.24L}{22.4L/mol}$×3×NA=0.3NA,故④正确;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,气体摩尔体积的条件应用,注意盐溶液中物料守恒的运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| B. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| C. | SiO2是酸性氧化物,能与水反应生成硅酸 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C 的生成速率与 C 的分解速率相等 | |
| B. | 单位时间内消耗 amolA,同时生成 3amolC | |
| C. | 容器内压强不再变化 | |
| D. | 混合气体的物质的量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质用于制作光导纤维 | |
| B. | Al2O3熔点很高,可用作耐火材料 | |
| C. | SO2可以用来漂白面条 | |
| D. | N2与O2在放电条件下直接化合生成NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
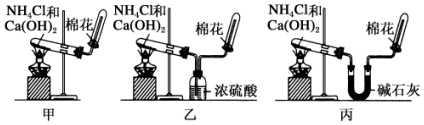
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 往溶液中加入盐酸,若放出能使澄清石灰水变浑浊的无色无味气体,则原溶液中只含CO32- | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com