
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(5)用相同浓度和体积的稀醋酸代替稀盐酸进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”)。
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2016-2017学年浙江省嘉兴市七校高一上期中化学试卷(解析版) 题型:选择题
将5 mol/L的盐酸10 mL稀释到200 mL,从中取出5 mL,这5 mL溶液的物质的量浓度为( )
A.0.5 mol/L B.0.25 mol/L C.0.1 mol/L D.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:填空题
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2: ;
②NaHSO4: ;
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________________
(2)砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测和法医学分析砒霜中毒的反应原理:As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O,①反应中还原剂是 ,被还原的元素是 ,(用化学式回答)若参加反应Zn的质量为19.5g,则生成的气体在标准状况下的体积为_________L,
②用双线桥法标出上述反应中电子转移的方向和数目。
(3)实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl.某学生设计了如图所示方案提取纯净的NaCl溶液.(已知:NH4HCO3 NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
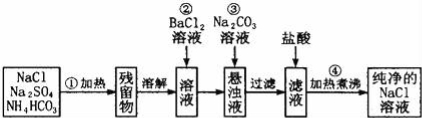
①150℃时,一定量的NH4HCO3完全分解后所得气体的平均相对分子质量为 (保留至小数点后一位).
②操作③所得到的悬浊液与胶体的本质区别是 .
③进行操作②后,判断SO42﹣是否已除尽方法是 .
④操作②加BaCl2溶液后生成沉淀,不必进行过滤就可进行操作③加碳酸钠溶液,其理由是 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
对下列实验过程的评价,正确的是( )
 A.某溶液中加稀硫酸生成无色气体,说明原溶液中有CO32-
A.某溶液中加稀硫酸生成无色气体,说明原溶液中有CO32-
B.某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊溶液显红色,该溶液一定显碱性
D.验证烧碱溶液中是否有Cl-,先加稀硝酸除去OH-,再加入AgNO3 ,有白色沉淀生成,证明含Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
下列实验操作中,正确的是( )
A. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
B. 用蒸发的方法使NaCl从溶液中析出时,玻璃棒的作用是引流
C. 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的液面以下
D. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:选择题
已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g) 2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法正确的是
A.NO分解反应NO(g)
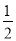 N2(g)+
N2(g)+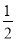 O2(g)的平衡常数为1×10-30
O2(g)的平衡常数为1×10-30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:选择题
下列过程中,需要增大化学反应速率的是
A.钢铁腐蚀 B.食物腐败 C.工业合成氨 D.塑料老化
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上月考三化学试卷(解析版) 题型:实验题
某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体和胆矾晶体。
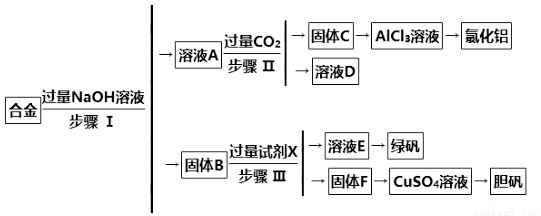
请回答:
(1)写出绿矾的化学式:______ ____________。试剂X是 。
____________。试剂X是 。
(2)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是____________。
(3)溶液E得到绿矾晶体的实验操作 。
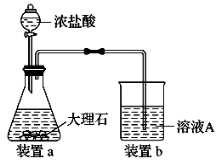
(4)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察 到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是__________。
到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是__________。
(5)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式:__________________________,
请选出你认为的最佳途径并说明选择的理由:______________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.根据溶液中有CH3COOH、CH3COO-和H+即可证明CH3COOH达到电离平衡状态
B.根据溶液中CH3COO-和H+的物质的量浓度相等即可证明CH3COOH达到电离平衡状态
C.当NH3·H2O达到 电离平衡时,溶液中NH3·H2O、NH4+和OH-的浓度相等
电离平衡时,溶液中NH3·H2O、NH4+和OH-的浓度相等
D.H2CO3是分步电离的,电离程度依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com