
| A. | 使酚酞变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | NaClO和NaCl混合溶液中:H+、NH4+、SO42-、Br- | |
| C. | 氯化亚铁溶液中:Na+、Ba2+、Br-、NO3- | |
| D. | 0.1 mol•L-1的NaAlO2 溶液:H+、Na+、Cl-、SO42- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取ag混合物充分加热,剩余bg固体 | |
| B. | 取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg | |
| C. | 取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 | |
| D. | 取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | - | Cl- | |
| ② | KClO3 | 浓盐酸 | - | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中①组的反应可能有一种或两种元素被氧化 | |
| D. | 表中③组反应的离子方程式为:2MnO${\;}_{4}^{-}$+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
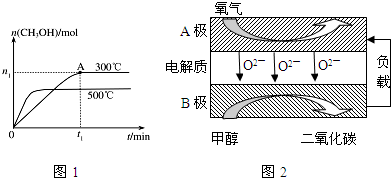
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c({H}^{+})}$>1.0×10-7mol/L | |
| B. | 往滤液中加水稀释,所有离子浓度都会减小 | |
| C. | c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取某溶液进行焰色反应 | 火焰呈黄色 | 溶液中有K+ |
| D | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com