
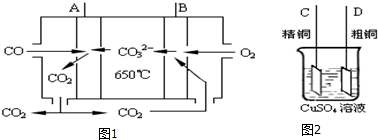
分析 (1)①CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;
②A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;
③电子得失守恒以及粗铜中除了铜失去电子还有其他金属失去电子.
(2)①电解时阴离子向阳极移动,Fe在阳极失电子,在碱性条件下被氧化为FeO42-;
②依据电极反应电子守恒计算阴极生成的气体为氢气的体积.
解答 解:(1)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,
故选:D;
③当消耗1.12L(标况下)CO时,转移0.1mol电子,生成0.05molCu,为0.05mol×64g/mol=3.2g,因粗铜中除了铜失去电子还有其他金属失去电子,根据电子得失守恒可知减少铜的质量小于3.2克,
故答案:3.2;
(2)①电解时阴离子向阳极移动,则OH-向阳极移动;用铁作阳极,电解KOH溶液制备高铁酸钾,电解过程中,阳极的电极反应是铁失电子生成高铁酸根离子,结合碱溶液中氢氧根离子电荷配平得到电解反应为Fe-6e-+8OH-=FeO42-+4H2O;
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
②电解一段时间后,若阳极质量减少28g,为铁,物质的量=$\frac{28g}{56g/mol}$=0.5mol,则在此过程中,阴极电极反应为2H++2e-=H2↑,依据电子守恒Fe~6e-~3H2,阴极析出的气体在标准状况下的体积=3×0.5mol×22.4L/mol=33.6L,
故答案为:33.6.
点评 本题考查了原电池原理和电解池原理的应用,题目难度中等,侧重于考查学生对基础知识的应用能力和计算能力,注意把握电极方程式的书写方法和电子守恒在计算中的应用.


科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的实质是电子转移 | B. | 氧化剂在反应中本身被还原 | ||
| C. | 氧化反应和还原反应同时进行 | D. | 氧化还原反应一定有单质参加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
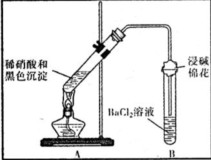 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能说明H2CO3是弱电解质:HCO3-+H2O?H2CO3+OH- | |
| B. | 能说明溶解性AgCl强于AgI:AgCl+I-═Cl-+AgI | |
| C. | 能说明盐酸是强酸:HCl+AgNO3═AgCl↓+HNO3 | |
| D. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
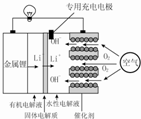
| A. | 该电池放电时,正极的电极反应为O2+4H++4e-═2H2O | |
| B. | 该电池充电时,阴极发生了氧化反应:Li++e-═Li | |
| C. | 电池中的有机电解液可以用稀盐酸代替 | |
| D. | 正极区产生的LiOH可回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
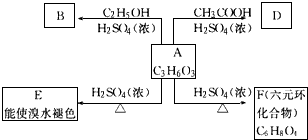
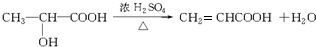 ;A→F
;A→F
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com