
| A、c(CN-)>c(F-) |
| B、c(Na+)=c(CN-)=c(F-) |
| C、NaCN水解程度比NaF大 |
| D、两者所含水分子总数相等 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、明矾净水和家用消毒剂的消毒原理相同 |
| B、使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| C、铝合金的广泛使用是因为人们能用焦炭等还原剂从氧化铝中获取铝 |
| D、钒氮合金钢是“鸟巢”的主要材料之一,其熔点、硬度和强度均高于纯铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打溶液与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| D、Fe溶于稀硫酸:Fe+3H+=Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
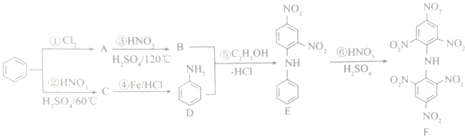
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
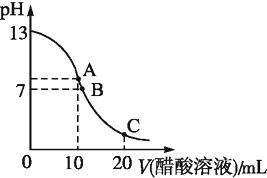 25℃时,在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
25℃时,在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )| A、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)) |
| C、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D、在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
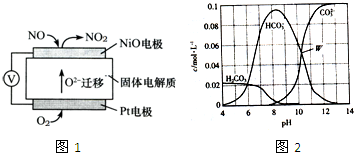 根据化学反应原理,回答下列问题:
根据化学反应原理,回答下列问题:c(HC
| ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀HNO3 |
| HCl |
| O2/点燃 |
| H2O |
| KMnO4(s) |
| NaOH(aq) |
| HCl |
| △ |
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com