
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
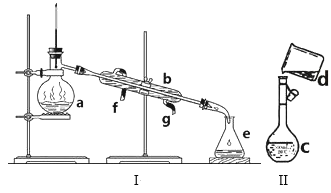
(1)写出下列仪器的名称:a.__ b.__ c.__。
(2)仪器a~e中,使用前必须检查是否漏水的有__。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__,将仪器补充完整后进行实验,温度计水银球的位置在__处。冷凝水由__(填f或g)口通入,__口流出。
(4)现需配制0.1mol/LNaOH溶液500mL,装置II是某同学转移溶液的示意图。
①图中的错误是__。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:___。
②根据计算得知,所需NaOH的质量为__g。
③配制时,正确操作顺序是(字母表示,每个字母只用一次)__。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
④用“偏大”“偏小”或“无影响”填空
A.配制NaOH溶液,需称量一定质量的溶质,称量时使用了游码,但物码放置颠倒__。
B.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容__。
C.定容摇匀后,发现液面下降,继续加水至刻度线__。
D.定容时仰视刻度线__。
E.容量瓶中原有少量蒸馏水__。
【答案】蒸馏烧瓶 冷凝管 容量瓶 c 酒精灯 蒸馏烧瓶支管口的下沿 g f 未用玻璃棒引流 药匙、玻璃棒、胶头滴管 2.0 BCAFED 偏小 偏大 偏小 偏小 无影响
【解析】
(1)由装置图可知仪器的名称:a为蒸馏烧瓶,b为冷凝管,c为容量瓶;答案:蒸馏烧瓶;冷凝管;容量瓶。
(2)由装置图可知仪器a~e中,a为蒸馏烧瓶,b为冷凝管,c为容量瓶,d为烧杯,e为锥形瓶,使用前必须检查是否漏水的是容量瓶,故答案:c。
(3)因为四氯化碳和酒精为互溶的混合物,需用蒸馏的方法进行分离,所以还缺少的仪器是酒精灯,将仪器补充完整后进行实验,温度计水银球的位置在蒸馏烧瓶支管口处。冷凝水由g口通入,f口流出;答案:酒精灯;蒸馏烧瓶支管口的下沿; g ;f。
(4)①装置II是某同学转移溶液的示意图,图中的错误是未用玻璃棒引流;除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有:药匙、玻璃棒、胶头滴管。答案:未用玻璃棒引流;药匙、玻璃棒、胶头滴管;
②现需配制0.1mol/LNaOH溶液500mL,所需NaOH的质量为0.1mol/L ![]() 0.5L
0.5L![]() 40g/mol=2.0g;答案:2.0g;
40g/mol=2.0g;答案:2.0g;
③配制一定物质的量浓度溶液一般步骤:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等,所以正确的顺序为: BCAFED;
④A.配制NaOH溶液,需称量NaOH溶质,称量时使用了游码,但物码放置颠倒,导致称得的质量减小,所配溶液浓度偏低,答案:偏小;
B.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容所加溶剂的体积减小,所配溶液浓度偏高,答案:偏大;
C.定容摇匀后,发现液面下降,继续加水至刻度线导致溶液的体积增大,所配溶液浓度偏低,答案:偏小;
D.定容时仰视刻度线溶液的体积增大,所配溶液浓度偏低,答案:偏小;
E.容量瓶中原有少量蒸馏水不影响所配溶液浓度;答案:不影响;
答案:偏小;偏大;偏小;偏小;无影响。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸的三个阶段:煅烧、氧化、吸收。煅烧黄铁矿的化学方程式为:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2。
完成下列填空:
(1)煅烧黄铁矿在________(填设备名称)中进行,此反应中被氧化的元素是___________。
(2)SO2的催化氧化:2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K= ______;反应达到平衡,及时分离出SO3,则平衡向_________方向移动(选填“正反应”“逆反应”)。其他条件不变,降低温度平衡向正反应方向移动,则正反应为__________反应(选填“吸热”“放热”)。
2SO3(g),该反应的平衡常数表达式为K= ______;反应达到平衡,及时分离出SO3,则平衡向_________方向移动(选填“正反应”“逆反应”)。其他条件不变,降低温度平衡向正反应方向移动,则正反应为__________反应(选填“吸热”“放热”)。
(3)下图为二氧化硫与氧气反应的速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是______(选填编号)。

a. 增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
改变条件后,平衡混合物中SO3的百分含量_______(选填“增大”“减小”“不变”)。
(4)SO3的吸收:SO3 + H2O → H2SO4 。假定制备硫酸的整个过程中S元素共损失10%,则含1000 kg FeS2的黄铁矿可以制得98%的浓硫酸_____________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,分别向体积均为20mL、浓度均为0.1mol/L的HX、HY溶液中滴加同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。已知pOH水![]() 水(OH-),
水(OH-),![]() 水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
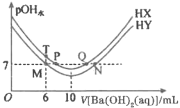
A.室温下,Ka(HX)>Ka(HY)
B.Q点溶液呈中性,溶液中c(X-)=2c(Ba2+)
C.T点溶液中阴离子浓度之和大于M点
D.室温下,水解常数Kh(Y-)=6.7×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁和氧化铜的固体混合粉末Xg,高温下用足量的一氧化碳还原,得到金属混合物2.4 g,将生成的二氧化碳气体用足量的澄清石灰水吸收后,产生5 g白色沉淀,则X的值为( )
A.2.45
B.3.20
C.4.00
D.7.40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请用对应的化学符号回答下列问题:

(1)D在元素周期表中的位置是____。
(2)E元素所形成的气态氢化物的电离方程式____。
(3)B、C两元素的单质较活泼的是___。(填元素符号)
(4)F是形成化合物最多的一种元素,它有多种单质请写出其中的两种:___、___。
(5)C是大自然赐予人类的宝物。将少量C单质置于足量氢氧化钠溶液中,可以观察到的现象为__。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为__C表现出的性质是___(氧化性/还原性),反应时可观察到的实验现象有___(填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C有熔融物生成
(6)C元素的最高价氧化物对应的水化物的化学式为___,该物质___(填“能”或“不能”)溶于氨水,___(填“能”或“不能”)溶于氢氧化钠溶液,若能写出发生反应的离子方程式___。
(7)G元素的非金属性比H元素的非金属性___(选填“强”、“弱”),能说明这一事实的化学方程式是___(任写一个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两同学为制得纯净的Fe(OH)2,使用如图所示的装置,A管中是Fe和H2SO4,B管中是NaOH溶液:

(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是___________;
(2)同学乙:打开a,使A管中反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是___________,B中发生反应的离子方程式为____________________________________
(3)在制备纯净的Fe(OH)2实验中,一定要注意避免Fe(OH)2被氧化,一旦实验失败就会看到白色絮状沉淀逐渐变为灰绿色,最后变成红褐色,请写出这个过程的化学方程式,并用单线桥法标出电子转移的方向和数目:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
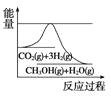
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com