

| ||
| 催化剂 |
| ||
| 催化剂 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
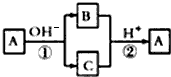
| A、X元素一定为非金属元素 |
| B、X元素可能为Al |
| C、反应①和②互为可逆反应 |
| D、反应①和②可能为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
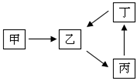 甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 | 用CCl4萃取 溴水中的溴 | 从NaCl与I2的混合物中回收I2 | 制备与收集二氧化硫 | 制备乙酸丁酯 |
| 装置 |  |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 使用锂离子电池为动力汽车,可减少有害气体的排放.锰酸锂离子蓄电池的反应式为:Li1-xMnO4+LixC
使用锂离子电池为动力汽车,可减少有害气体的排放.锰酸锂离子蓄电池的反应式为:Li1-xMnO4+LixC| 放电 |
| 充电 |
| A、充电时电池内部Li+向正极移动 |
| B、放电过程中,电能转化为化学能 |
| C、放电时电池的正极反应式为:Li1-xMnO4+xe-+xLi+=LiMnO4 |
| D、充电时电池的正极应与外接电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验室在蒸发皿中灼烧干海带,并且用玻璃搅拌 |
| B、含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 |
| C、在碘水中加入几滴淀粉溶液,溶液变蓝色 |
| D、碘水中加入CCl4得到I2的CCl4的溶液,该操作为“萃取” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与pH=12NaOH溶液等体积混合液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com