
| n |
| V |
| 0.25mol |
| 18.4mol/L |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
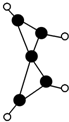 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示,下列说法中不正确的是( )| A、该分子的分子式为C5H4 |
| B、该分子中碳原子的化学环境有2种 |
| C、1mol X在一定条件下可与2mol H2发生反应 |
| D、该分子中只有C-C键,没有C═C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应均为氧化还原反应 |
| B、催化剂能改变可逆反应达到平衡的时间 |
| C、金属氧化物均为碱性氧化物 |
| D、石油是混合物,其分馏产品汽油为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键 |
| B、任何分子间在任意情况下都会产生范德华力 |
| C、范德华力与化学键的区别是作用力的强弱问题 |
| D、范德华力非常微弱,故破坏范德华力不需要消耗能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究控制汽车尾气成为保护环境的重要任务.汽车内燃机工作时发生反应:
研究控制汽车尾气成为保护环境的重要任务.汽车内燃机工作时发生反应:| 温度(℃) | c(氨水)(mol/L) | 电离常数 | 电离度(%) | c(OH-)(mol/L) |
| 0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
| 10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
| 20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
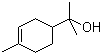 )的分子式为
)的分子式为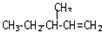 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为短周期元素且原子序数依次增大,其中A含有3个能级且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强.
A、B、C、D、E为短周期元素且原子序数依次增大,其中A含有3个能级且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com