
 某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体H2、CO2(答2种即可);若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体H2,写出反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体H2、CO2(答2种即可);若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体H2,写出反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑. 分析 根据启普发生器对反应物、反应条件的要求判断,根据铁的性质判断其它气体不能制取的原因,并写出相应的离子方程式.
解答 解:使用启普发生器时对反应物、反应条件的要求是:固、液不加热型或液、液不加热型,所以可制取的气体有H2、CO2 等;将铜网改为铁网时,铁和稀盐酸、稀硫酸都反应,所以只能用于碱和金属反应生成的气体,可制取的气体只有H2,强碱和铝反应生成偏铝酸盐和氢气2Al+2OH-+2H2O═2AlO2-+3H2↑.故答案为:H2 CO2;H2;2Al+2OH-+2H2O═2AlO2-+3H2↑.
点评 本题考查了常见气体的制取和实验装置的选择,同时考查了铝的两性;对铝的两性知识的考查,先要审清实验的装置为封闭体系,联想类比自己原有知识体系,熟练提取铝的两性存储的知识,正确解答问题.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O?NH4++OH- | B. | Ba(OH)2═Ba2++2OH- | ||
| C. | H2SO4═2H++SO42- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 | |
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 | |
| C. | 把化学反应中物质的变化和反应的焓变同时表示出的化学方程式叫做热化学方程式 | |
| D. | 氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| [H2]/mol•L-1 | [Cl2]/mol•L-1 | v/mol•L-1•s-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1、n=1 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$、n=1 | D. | m=1、n=$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌作阳极,镀件作阴极,溶液中有锌离子 | |
| B. | 铂作阴极,镀件作阳极,溶液中有锌离子 | |
| C. | 铁作阳极,镀件作阴极,溶液中有锌离子 | |
| D. | 锌作阴极,镀件作阳极,溶液中有锌离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
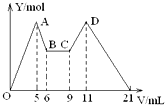 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )| A. | 从6到9,相应离子反应方程式为H++OH-=H2O | |
| B. | A 是NaOH,B是盐酸,且c(NaOH):c( HCl)=2:1 | |
| C. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| D. | A是盐酸,B是NaOH,且c(NaOH)=2c (HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石英与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| C. | 向硅酸钠溶液中加入盐酸:2H++SiO32-═H2SiO3↓ | |
| D. | 向碳酸钙上滴稀硝酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 达到平衡时X浓度为0.04 mol•L-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015 mol•L-1 | |
| C. | 若升高温度,X的体积分数增大,则该反应的?△H<0 | |
| D. | 若增大压强,平衡向正反应方向移动,平衡常数变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com