
 高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.分析 (1)根据题干信息:在KOH溶液中,用KC1O直接氧化Fe(NO3)3即可制得K2FeO4来书写离子方程式;
(2)①反应中Cr的化合价从+3价升高到了+6价,失去3mol电子,Fe元素的化合价从+6价降低到了+3价,得到3mol电子,根据电子守恒、元素守恒来配平方程式;
②根据发生的反应得到如下关系:K2FeO4~CrO42-~0.5Cr2O72-~3Fe2+,据此计算;
(3)①根据pH和组分的物质的量分数之间的关系来判断;为获得尽可能纯净的高铁酸盐,要求溶液中只含有高铁酸根离子,据图数据回答;
②已知H3FeO4+的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,据电离平衡常数表达式计算;
③据图示可以看出pH=6的高铁酸盐溶液中含有HFeO4-,加入KOH溶液会发生反应;
(4)在原电池中,K2FeO4在正极上发生得电子的还原反应,据此书写电极反应式.
解答 解:(1)在KOH溶液中,用KC1O直接氧化Fe(NO3)3即可制得K2FeO4,即次氯酸根离子氧化铁离子的过程,反应的离子方程式为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O,故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(2)①反应中Cr的化合价从+3价升高到了+6价,失去3mol电子,Fe元素的化合价从+6价降低到了+3价,得到3mol电子,根据电子守恒,所以Cr(OH)4-、FeO42-、Fe(OH)3(H2O)3↓、CrO42-的前边系数都是1,根据电荷守恒,产物还有1molOH-,根据H、O元素守恒,所以反应物加上3mol水,即Cr(OH)4-+FeO42-+3H2O=Fe(OH)3(H2O)3↓+CrO42-+OH-,故答案为:1;1;3H2O;1;1;1OH-;
②根据发生的反应得到如下关系:K2FeO4~CrO42-~0.5Cr2O72-~3Fe2+,用c mol.L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL,即消耗Fe2+的物质的量是cV×10-3mol,所以该样品的纯度为$\frac{\frac{1}{3}×V×1{0}^{-3}×cmol/L×198g/mol}{mg}$,故答案为:$\frac{\frac{1}{3}×V×1{0}^{-3}×cmol/L×198g/mol}{mg}$;
(3)①根据pH和组分的物质的量分数之间的关系图,得出:c(H2FeO4)>c(H3FeO4+)>c(HFeO4-);为获得尽可能纯净的高铁酸盐,要求溶液中只含有高铁酸根离子,需要pH≥9;故答案为:c(H2FeO4)>c(H3FeO4+)>c(HFeO4-);≥9;
②已知H3FeO4+的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,当pH=4时,溶液中$\frac{c(HFe{O}_{4}^{-})}{c({H}_{2}Fe{O}_{4})}$=$\frac{4.16×1{0}^{-4}}{1{0}^{-4}}$=4.16,
故答案为:4.16;
③向pH=6的高铁酸盐溶液中(据图示可以看出其中含有HFeO4-)加入KOH溶液,则HFeO4-和KOH溶液之碱反应,即HFeO4-+OH-=FeO42-+H2O,故答案为:HFeO4-+OH-=FeO42-+H2O;
(4)在原电池中,K2FeO4在正极上发生得电子的还原反应,电极反应式为:K2FeO4+xe-+xLi+=K2LixFeO4,故答案为:K2FeO4+xe-+xLi+=K2LixFeO4.
点评 本题综合考查学生电化学电极反应式的书写、溶液中离子之间的反应,侧重学生识图能力的考查,难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:解答题
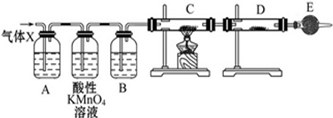
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③⑤⑥ | C. | ③④⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
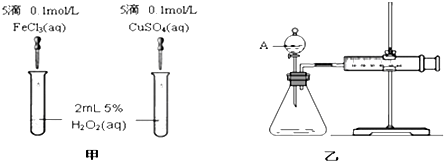
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1H、2H、H+都可说成是氢元素的不同微粒 | |
| B. | 16O2和18O2互为同位素,化学性质相同 | |
| C. | 铝原子的结构示意图: | |
| D. | 甲烷的结构式:CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
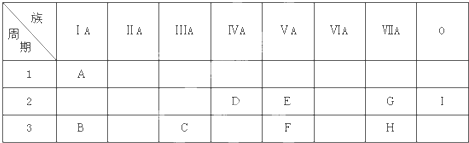
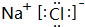 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大烧杯上没有盖硬纸板 | |
| B. | 用环形铜丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用相同浓度和体积的硝酸代替稀盐酸溶液进行实验 | |
| D. | 用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com