

| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集CH4气体 | |
| C. | 图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应 | |
| D. | 图④中的装置可形成原电池,电流从锌片经导线流向铜片 |
分析 A.盐酸易挥发,盐酸与硅酸钠反应;
B.甲烷密度比空气密度小;
C.由图可知,反应物总能量高;
D.Cu为负极,Zn为正极.
解答 解:A.盐酸易挥发,盐酸与硅酸钠反应,则不能比较碳酸、硅酸的酸性,不能比较C、Si非金属性,故A错误;
B.甲烷密度比空气密度小,则图中向下排空气法收集合理,故B正确;
C.由图可知,反应物总能量高,则可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应,故C正确;
D.Cu为负极,Zn为正极,则原电池中电流从铜片经导线流向锌片,故D错误;
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
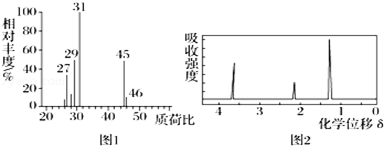
| A. | 由图1可知A的相对分子质量为46 | B. | 由图2可知A分子中有3个氢原子 | ||
| C. | 该有机物的实验式可能为C2H6O | D. | A的结构简式可能为CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为2mol•L-1 | B. | 上述电解过程中共转移2mol电子 | ||
| C. | 电解得到铜的物质的量为0.5mol | D. | 电解后溶液中c(H+)为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
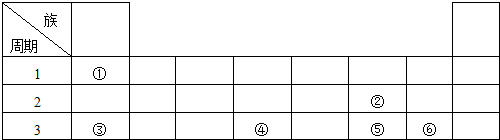
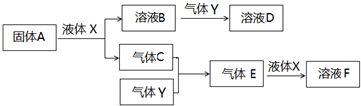
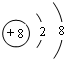 .
.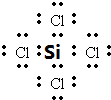 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与D形成的化合物中只有离子键 | |
| B. | 由C、D、E三元素形成的化合物与A、C、E三元素形成的化合物可能反应 | |
| C. | A、B、C形成的化合物一定不能发生水解反应 | |
| D. | E的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2-和${NH}_{2}^{-}$ | B. | H3O+和ClO3- | C. | NO3-和CH3+ | D. | PO43-和SO42-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com