
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mo1)随时间t的变化如图2-10-2所示。已知达平衡后,降低温度,A的转化率将 增大。
增大。

(1)根据图 2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是________________。
(3)图2-10-3表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
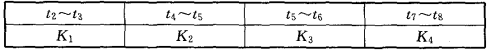
根据图2-10-3判断,在t3和t6时刻改变的外界条件分别是__________和____________;K1、K2、K3、K4之间的关系为__________(用“>”“<”或“=”连接)。平衡时A的转化率最大的一段时间是____________。
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下列每组物 质中含有的化学键类型相同的是( )
质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH B.Cl2、Na2S、HCl、SO2
C.HBr、CO2 、H2O、CS2 D.Na2O2、H2O2、H2O、O3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
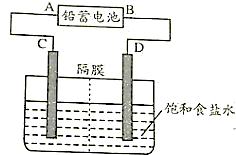
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨,已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是

A.电路中通过1mol电子时,Y电极质量增加48g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-===PbSO4(s)+2H2O(l)
C.c、d电极产生气体的物质的量之比为1∶2
D.X极为负 极
极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g)=2H2O(g)ΔH=—483.6kJ·mol-1,则H2燃烧热为241.8kJ·mol-1
B.若C(石墨,s)=C(金刚石,s)ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=—57.4kJ·mol-1,则20.0gNaOH固体与稀盐酸完全中和 ,放出28
,放出28 .
. 7kJ的热量
7kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g)ΔH1;2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
对于可逆反应N2(g)+3H2(g) 2NH3(g) △H<0,下列研究目的和示意图相符的是
2NH3(g) △H<0,下列研究目的和示意图相符的是
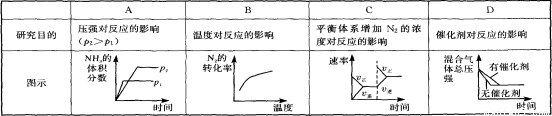
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)?N2O4(g)(正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g)(正反应为吸热反应) | |
| C. | H2(g)+I2(g)?2HI (g)(正反应为放热反应) | |
| D. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
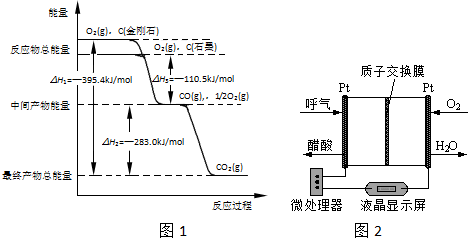
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com