
分析 n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,n(NaOH)=1mol/L×0.4L=0.4mol,发生的反应是CO2+2NaOH=Na2CO3+H2O,Na2CO3+CO2+H2O=2NaHCO3,根据化学反应方程式计算.
解答 解:n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,n(NaOH)=1mol/L×0.4L=0.4mol,
CO2+2NaOH=Na2CO3+H2O,0.4molNaOH完全反应,
1 2 1
0.2 0.4 0.2
反应后剩余的是CO2是0.3mol-0.2mol=0.1mol,
Na2CO3+CO2+H2O=2NaHCO3,
1 1 2
0.1 0.1 0.2
因此Na2CO3的物质的量为0.2mol-0.1mol=0.1mol,NaHCO3的物质的量为0.2mol,
答:生成的盐的成分为0.1molNa2CO3、0.2molNaHCO3.
点评 本题考查混合物的有关计算,为高频考点,注意掌握碳酸钠、碳酸氢钠的化学性质,有利于提高学生的分析、理解能力及化学计算能力,难度中等.


科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
下列关于物质的量浓度表述正确的是
A.0.2mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B.50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D.10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,滴加硫氰化钾溶液 | |
| B. | 取样,加足量的浓NaOH溶液加热,用湿润的红色石蕊试纸检验气体 | |
| C. | 取样,逐滴滴入氢氧化钠溶液直至足量 | |
| D. | 取样,加足量盐酸加热,湿润的品红试纸检验气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色液体 | B. | 可以被氧化 | ||
| C. | 能与水以任意比例混溶 | D. | 能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
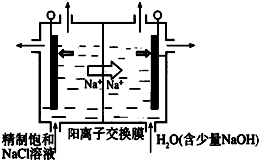 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 铝的还原性很强,铝热反应可以冶炼Fe、V、Cr等难熔化金属 | |
| D. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
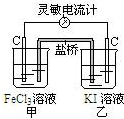
| A. | 反应开始时,乙中石墨电极上发生还原反应 | |
| B. | 反应开始时,甲中石墨电极上Fe3+被氧化 | |
| C. | 盐桥中的K+向乙中迁移,Cl-向甲中迁移 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com