
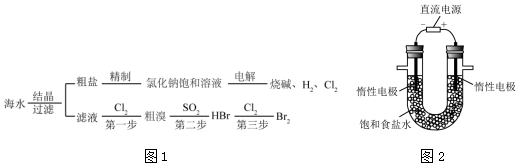
分析 (1)先加入过量氯化钡除去硫酸根离子,然后加入NaOH溶液,使镁离子转化为Mg(OH)2,加入Na2CO3溶液,使溶液中钡离子、钙离子转化为CaCO3,为了除尽杂质,最后加入盐酸除去过量的碳酸钠、氢氧化钠;
(2)电解饱和食盐水溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极上有氢氧根离子生成,根据氢氧根离子浓度的变化判断溶液PH的变化;
(3)氯气具有氧化性,能氧化溴离子生成单质溴;
(4)通过萃取操作将溴从溶液中分离;
(5)萃取:利用溶质在互不相溶的溶剂里的溶解度的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来.根据萃取的定义知:
萃取剂必须具备下列条件:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应.
解答 解:(1)加入过量②氯化钡除去硫酸根离子,然后加入③NaOH溶液,使镁离子转化为Mg(OH)2,加入④Na2CO3溶液,使溶液中钡离子、钙离子转化为BaCO3、CaCO3,过滤后,最后加入①盐酸除去过量的碳酸钠、氢氧化钠,所以正确顺序为:②③④①,
故答案为:B;
(2)电解饱和食盐水时,与电源正极相连的电极上氯离子失电子发生氧化反应,电极反应式为:发生的反应为2Cl--2e→Cl2,阴极上氢离子得电子生成氢气,同时阴极附近生成氢氧根离子,溶液呈碱性,pH变大,电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中生成氢氧化钠,所以反应方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,
故答案为:变大;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;
(3)由于氯气具有氧化性,能氧化溴化钠生成单质溴:Cl2+2NaBr=Br2+2NaCl,
故答案为:Cl2+2NaBr=Br2+2NaCl;
(4)要使最终生成的Br2从水溶液中分离,常先加入有机溶剂四氯化碳,使溶液分层,然后通过分液操作,获得溴的四氯化碳溶液,最后分馏获得溴单质,
故答案为:B;E;
(5)要使最终生成的Br2从水溶液中分离,先加入有机溶剂四氯化碳,使溶液分层,然后通过分液操作,获得溴的四氯化碳溶液,最后分馏获得溴单质,萃取剂必须具备下列条件:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应,
故答案为:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应.
点评 本题考查了原电池原理和电解池原理、除杂等知识点,题目难度中等,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性,即使燃料和氧化剂相同,电解质溶液不同则电极反应式也不同,为易错点


科目:高中化学 来源: 题型:选择题
| A. | H2(HCl):通过水洗涤 | B. | NO(NH3):通过水洗涤 | ||
| C. | NH4Cl(I2):加热混合物 | D. | NH4Cl溶液(I2):用CCl4萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 用向上排空气法可以收集NO气体 | |
| C. | 配制硫酸亚铁溶液时,要加入适量的铁粉和稀硫酸 | |
| D. | 配制浓H2SO4和浓HNO3的混酸时,应将H2SO4慢慢加到浓HNO3中,并及时搅拌和冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 32种 | D. | 64种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.
现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com