
一定条件下,浓H2SO4能与多种非金属单质反应,如:S+2H2SO4(浓) 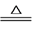 3SO2↑+2H2O。下列有关该反应的说法正确的是
3SO2↑+2H2O。下列有关该反应的说法正确的是
A. S是氧化剂 B. S得到电子
C. 浓H2SO4发生还原反应 D. 1molH2SO4转移电子的数目为4mol
科目:高中化学 来源:2017届山东省临沂市高三上学期期末考试化学试卷(解析版) 题型:推断题
有机化合物G常用作香料,合成G的一种路线如下:
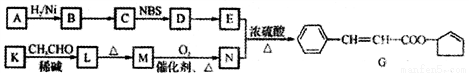
已知以下信息:
①A的分子式为C5H8O,核磁共振氢谱显示其有两种不同化学环境的氢
②CH3CH2CH=CH2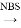 CH3CHBrCH=CH2
CH3CHBrCH=CH2
③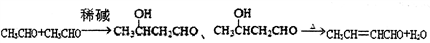
回答下列问题:
(1)A的结构简式为____________,D中官能团的名称为____________。
(2)B→C的反应类型为__________。
(3)D→E反应的化学方程式为__________________________________________。
(4)检验M是否已完全转化为N的实验操作是_____________________________________________________________________________________________________________。
(5)满足下列条件的L的同分异构体有____________种(不考虑立体异构),①能发生银镜反应 ②能发生水解反应,③属于芳香族化合物,其中核磁共振氢谱中有5组峰,且峰面积之比为1:2:2:2:3的所有可能结构的结构简式____________________________________。
(6)参照上述合成路线,设计一条以1-丁醇和NBS为原料制备顺丁橡胶
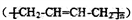 的合成路线:_____________________
的合成路线:_____________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
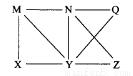
A. N一定是HCl(aq) B. X可能为Al或Cl2
C. Y一定为NaOH(aq) D. Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
下列关于实验操作的叙述中正确的是( )
A. 从试剂瓶中取出任何药品,若有剩余一定不能再放回原试剂瓶中
B. 可燃性气体点燃之前必须验纯
C. 用胶头滴管向试管中滴加液体,一定要将滴管伸入试管内
D. 用温度计搅拌溶液一定要慢慢搅拌
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
下列有机反应属于加成反应的是
A. CH3CH3+Cl2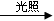 CH3CH2C1+HCl
CH3CH2C1+HCl
B. CH2=CH2+Br2→CH2BrCH2Br
C. 2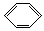 +15O2
+15O2 12CO2+6H2O
12CO2+6H2O
D. CH3COOH +CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
在含有大量Fe3+、Ag+、NO3-的溶液中,还可能大量共存的离子是
A. Ba2+ B. OH- C. Cl- D. CO32-
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:实验题
谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:
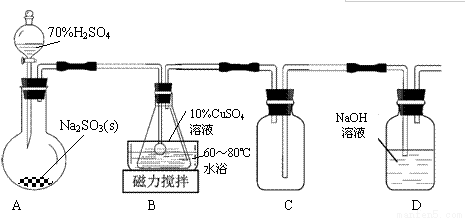
(1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是_______________。
(2)装置B中发生反应的离子方程式为_______________。
(3)装置C的作用是____________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
①检验洗涤已完全的方法是__________________。
②不用烘干的方式得到产品,其原因是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,_______________,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:①该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8,8.8);Cu(OH)2(4.2,6.7);Fe(OH)3(1.1,3.2)。②在水溶液中超过100℃,硫酸铜晶体易失去结晶水。③硫酸铜晶体溶解度曲线如右图所示]

查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:填空题
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol·L-1。
阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
① 用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
② 取少量溶液,加入KSCN溶液无明显变化。
③ 另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④ 向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是______,一定不含的阴离子是_______(写离子符号)。
(2)③中加入少量盐酸生成无色气体的的离子方程式是_____________,
④中生成白色沉淀的离子方程式是_______________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为_________。
(4)甲同学最终确定原溶液中所含阳离子是_________,阴离子是________。(写离子符号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com