
【题目】某同学在实验室中进行如图所示实验。
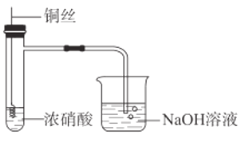
(1)铜丝与浓硝酸发生反应的离子方程式是________。
(2)烧杯中NaOH溶液的作用是________。
(3)铜丝下端弯成螺旋状的原因是________。
(4)根据反应产生的现象,从不同角度推断该反应所属反应类型:
①根据________现象,可推断该反应为氧化还原反应。
②根据反应后试管壁发热的现象,可推断该反应属于________反应。
【答案】![]() ↑ 吸收尾气,防止污染 增大与浓硝酸的接触面积,加快反应速率 有气体生成 放热
↑ 吸收尾气,防止污染 增大与浓硝酸的接触面积,加快反应速率 有气体生成 放热
【解析】
铜与浓硝酸反应生成硝酸铜、二氧化氮和水,烧杯中氢氧化钠具有尾气处理的作用。
(1)铜丝与浓硝酸发生反应的离子方程式是:![]() ↑,故答案为:
↑,故答案为:![]() ↑;
↑;
(2)二氧化氮会污染环境,烧杯中NaOH溶液具有尾气处理的作用,故答案为:吸收尾气,防止污染,故答案为:吸收尾气,防止污染;
(3)铜丝下端弯成螺旋状的原因是增大与浓硝酸的接触面积,加快反应速率,故答案为:增大与浓硝酸的接触面积,加快反应速率;
(4) ①根据有气体生成的现象,可知浓硝酸中+5价的N元素的化合价降低,推断该反应为氧化还原反应,故答案为:有气体生成;
②根据反应后试管壁发热的现象,可推断该反应属于放热反应,故答案为:放热。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组混合物的总物质的量一定,每组中的物质以任意比例相混合,完全燃烧时消耗氧气的量不变的是
A.甲烷、甲醇和甲醛B.甲醇、甲醛和甲酸
C.乙醇、乙烯和丙烯酸D.甲酸、乙二酸和乙二醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 氯气跟水反应:Cl2 + H2O= 2H++ Cl-+ ClO-
B. 食醋与氨水反应:NH3·H2O+H+= NH4++H2O
C. NaHCO3溶液中加少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D. 向Ba(OH)2溶液滴加NaHSO4溶液至Ba2+恰好沉淀:Ba2++2H++2OH-+SO42- = BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4 NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g),下列叙述正确的是
4NO(g)+6 H2O(g),下列叙述正确的是
A.NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O)
B.达到化学平衡时,4v正(O2)= 5v逆(NO )
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中.△H能正确表示物质的燃烧热的是( )
A.CO(g) +![]() O2(g) ==CO2(g); △H=-283.0 kJ/mol
O2(g) ==CO2(g); △H=-283.0 kJ/mol
B.C(s) +![]() O2 ==CO(g); △H=-110.5 kJ/mol
O2 ==CO(g); △H=-110.5 kJ/mol
C.H2(g) +![]() O2(g)==H2O(g); △H=-241.8 kJ/mol
O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)==16 CO2(g)+18 H2O(l); △H=-1136 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中有可逆反应:nA(g)+mB(g)![]() pC(g) △H>0处于平衡状态(已知m+n>p),则下列说法正确的是
pC(g) △H>0处于平衡状态(已知m+n>p),则下列说法正确的是
①升温,c(B)/c(C)的比值变小
②降温时体系内混合气体平均相对分子质量变小
③加入B,A的转化率增大
④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定降低
⑥若A的反应速率为VA,则B的反应速率为n·VA/m
A.①②③⑤B.①②③④C.①②⑤⑥D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2可与H2催化合成甲醇,于恒容密闭容器中,在催化剂作用下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);下列描述能说明该反应已经达到化学平衡状态的是( )
CH3OH(g)+H2O(g);下列描述能说明该反应已经达到化学平衡状态的是( )
A.CO2、H2、CH3OH、H2O在容器中共存
B.CO2、H2、CH3OH、H2O的浓度相等
C.正、逆反应速率相等且等于零
D.CO2、H2、CH3OH、H2O的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:
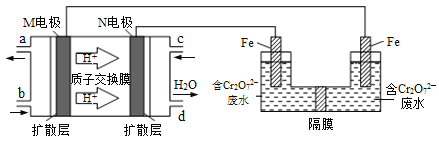
①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com